Disbiosis intestinal y su asociación con niveles de calprotectina y zonulina fecal en niños con trastornos del espectro autista
Resumen
Introducción: La disbiosis en niños con trastornos del espectro autista (TEA), puede inducir inflamación intestinal y alteraciones en la permeabilidad intestinal favoreciendo la presencia de manifestaciones gastrointestinales y neuroconductuales. Objetivo: Evaluar la relación que existe entre la disbiosis y los niveles fecales de zonulina y calprotectina en niños con TEA. Métodos: Los niveles de zonulina fueron evaluados mediante la técnica de inmunoensayo enzimático ligado a enzima (ELISA), calprotectina fecal por Turbidimetria y la disbiosis por el método de cultivo, en una cohorte de 40 niños con TEA y 18 niños normotípicos. Resultados: El 95% de los pacientes con TEA estudiados presentaron disbiosis intestinal. Un 65 % de los pacientes con disbiosis tenían niveles elevados de zonulina y/o calprotectina fecal. Se encontraron niveles elevados de zonulina fecal en 15% de los pacientes con TEA obteniendo un valor mediano de 44,5 (IQR=43,0) ng/mL en el grupo TEA y de 42,0 (IQR=19,0) ng/mL en el grupo control, sin diferencias significativas entre los dos grupos. Se encontraron niveles elevados de calprotectina fecal en el 60 % de los pacientes con TEA, obteniendo un valor mediano de 75,0 (IQR= 127,3) μg/g y en el grupo control de 21,0 (IQR=23,5) μg/g, siendo significativamente mayor la distribución de calprotectina en los pacientes con TEA que en el grupo control (W = 116,5, p<0,001). Conclusión: Se observó una relación entre la disbiosis, los síntomas gastrointestinales y los niveles elevados de calprotectina fecal en pacientes con TEA.
ESCUCHE EL RESUMEN HANCIENDO CLIC EN EL IDIOMA DE SU PREFERENCIA:
EspañolEnglish
Portugues
Palabras clave
Texto completo:
PDFReferencias
Baxter AJ, Brugha TS, Erskine HE, Scheurer RW, Vos T, Scott JG. The epidemiology and global burden of autism spectrum disorders. Psychol Med. 2015;45(3):601–13. doi: 10.1017/S003329171400172X
Oviedo N, Manuel L, Chesnaye E, Guerra C. Aspectos genéticos y neuroendocrinos en el trastorno del espectro autista. Bol Med Hosp Infant Mex. 2015;72(1):5–14.
Neuhaus E, Beauchaine TP, Bernier R. Neurobiological correlates of social functioning in autism. Clin Psychol Rev. 2010;30(6):733–48. doi: 10.1016/j.cpr.2010.05.007
Vogel A, Laufer BI, Dunaway KW, Hwang H, Mordaunt CE, Coulson RL, et al. Epigenomic convergence of genetic and immune risk factors in autism brain. bioRxiv. 2018;1:1–53. doi: 10.1101/270827
McElhanon BO, McCracken C, Karpen S, Sharp WG. Gastrointestinal symptoms in autism spectrum disorder: a meta-analysis. Pediatrics. 2014;133(5):872–83. doi: 10.1542/peds.2013-3995
McElhanon BO, McCracken C, Karpen S, Sharp WG. Gastrointestinal symptoms in autism spectrum disorder: a meta-analysis. Pediatrics. 2014;133(5):872–83. doi: 10.1542/peds.2013-3995
Adams JB, Johansen LJ, Powell LD, Quig D, Rubin RA. Gastrointestinal flora and gastrointestinal status in children with autism—comparisons to typical children and correlation with autism severity. BMC Gastroenterol. 2011;11(1):22. doi: 10.1186/1471-230X-11-22
Kushak RI, Buie TM, Murray KF, et al. Evaluation of intestinal function in children with autism and gastrointestinal symptoms. J Pediatr Gastroenterol Nutr. 2016;62(5):687–91. doi: 10.1097/MPG.0000000000001174
Sidler MA, Leach ST, Day AS. Fecal S100A12 and fecal calprotectin as noninvasive markers for inflammatory bowel disease in children. Inflamm Bowel Dis. 2008;14(3):359–66. doi: 10.1002/ibd.20336
Sipponen T, Kolho KL. Fecal calprotectin in diagnosis and clinical assessment of inflammatory bowel disease. Scand J Gastroenterol. 2015;50(1):74–80. doi: 10.3109/00365521. 2014.987809
Ikhtaire S, Shajib MS, Reinisch W, Khan WI. Fecal calprotectin: its scope and utility in the management of inflammatory bowel disease. J Gastroenterol. 2016;51(5):434–46. doi: 10.1007/s00535-016-1182-4
Alibrahim B, Aljasser MI, Salh B. Fecal calprotectin use in inflammatory bowel disease and beyond: a mini-review. Can J Gastroenterol Hepatol. 2015;29(3):157–63. doi: 10.1155/2015/950286
Fasano A. All disease begins in the (leaky) gut: role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Res. 2020;9:F1000 Faculty Rev-69. Doi: 10.12688/f1000 research.20510.1
Fasano A. Intestinal permeability and its regulation by zonulin: diagnostic and therapeutic implications. Clin Gastroenterol Hepatol. 2012;10(10):1096–100. doi: 10.1016/j.cgh.2012.08.012
Iftekhar A, Sigal M. Defence and adaptation mechanisms of the intestinal epithelium upon infection. Int J Med Microbiol. 2021;311(3):151486. doi: 10.1016/j.ijmm.2021. 151486
Sturgeon C, Fasano A. Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers. 2016;4(4):e1251384. doi: 10.1080/21688370.2016.1251384
Fasano A. Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer. Physiol Rev. 2011;91(1):151–75). doi: 10.1152/physrev.00003.2008
The World Medical Association Ethics Unit. Declaration of Helsinki [Internet]. 2024 [citado 2024 Ago 10]. Disponible en: http://www.wma.net/e/ethicsunit
American Psychiatric Association. Neurodevelopment disorders in: diagnostic and statistical manual of mental disorders. 5th ed. Washington, DC: American Psychiatric Publishing; 2014.
Lord C, Rutter M, Di Lavore P, Risi S, Gotham K, Bishop S. ADOS-2. Escala de observación para el diagnóstico del autismo - 2. Manual (Parte I): módulos 1-4. Madrid: TEA Ediciones; 2015. p. 11–216.
Svedlund J, Sjödin I, Dotevall G. GSRS—a clinical rating scale for gastrointestinal symptoms in patients with irritable bowel syndrome and peptic ulcer disease. Dig Dis Sci. 1988;33(2):129–34. doi: 10.1007/BF01535722
Moreno X, Santamaría G, Sánchez R, De La Torre B, Garcés F, Hernández C, et al. Microbiota gastrointestinal aeróbica en niños con trastorno del espectro autista. Estudio preliminar. Gen. 2015;69(2):36–44. Disponible en: https://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0016-35032015000200004
R Core Team. R: a language and environment for statistical computing. Vienna: R Foundation for Statistical Computing; 2023. Disponible en: https://www.scirp.org/ reference/referencespapers?referenceid=3582659
Aziz Q, Doré J, Emmanuel A, Guarner F, Quigley EM. Gut microbiota and gastrointestinal health: current concepts and future directions. Neurogastroenterol Motil. 2013;25(1):4–15. doi: 10.1111/nmo.12046
Kang S, Denman S, Morrison M, Yu Z, Doré J, Leclerc M. Dysbiosis of faecal microbiota in Crohn’s disease patients as revealed by a custom phylogenetic microarray. Inflamm Bowel Dis. 2010;16(12):2034–42. doi: 10.1002/ibd.21319
Uranga JA, López-Miranda V, Lombó F, Abalo R. Food, nutrients and nutraceuticals affecting the course of inflammatory bowel disease. Pharmacol Rep. 2016;68(4):816–26. doi: 10.1016/j.pharep.2016.05.002
Jeffery IB, O'Toole PW, Öhman L, Claesson MJ, Deane J, Quigley EM, et al. An irritable bowel syndrome subtype defined by species-specific alterations in faecal microbiota. Gut. 2012;61(7):997–1006. doi: 10.1136/gutjnl-2011-301 501
Azhari A, Azizan F, Esposito G. A systematic review of gut-immune-brain mechanisms in autism spectrum disorder. Dev Psychobiol. 2019;61(5):752–71. doi: 10.1002/dev.2180 3
Coury DL, Ashwood P, Fasano A, Fuchs G, Geraghty M, Kaul A, et al. Gastrointestinal conditions in children with autism spectrum disorder: developing a research agenda. Pediatrics. 2012;130(Suppl 2):S160–8. doi: 10.1542/peds.2 012-0900N
Horvath K, Perman JA. Autism and gastrointestinal symptoms. Curr Gastroenterol Rep. 2002;4(3):251–8. doi: 10.1007/s11894-002-0071-6.
Iovene MR, Bombace F, Maresca R, Sapone A, Iardino P, Picardi A, et al. Intestinal dysbiosis and yeast isolation in stool of subjects with autism spectrum disorders. Mycopathologia. 2017;182(3–4):349–63. doi: 10.1007/s110 46-016-0068-6
van De Sande MM, van Buul VJ, Brouns FJ. Autism and nutrition: the role of the gut-brain axis. Nutr Res Rev. 2014;27(2):199-214. doi: 10.1017/S0954422414000110
Julio-Pieper M, Bravo JA, Aliaga E, Gotteland M. Review article: intestinal barrier dysfunction and central nervous system disorders--a controversial association. Aliment Pharmacol Ther. 2014;40(10):1187-1201. doi: 10.1111/apt. 12950
de Magistris L, Familiari V, Pascotto A, Sapone A, Frolli A, Iardino P, et al. Alterations of the intestinal barrier in patients with autism spectrum disorders and in their first-degree relatives. J Pediatr Gastroenterol Nutr. 2010;51(4):418-24. doi: 10.1097/MPG.0b013e3181dcc4a5
Esnafoglu E, Cırrık S, Ayyıldız SN, Erdil A, Ertürk EY, Daglı A, et al. Increased serum zonulin levels as an intestinal permeability marker in autistic subjects. J Pediatr. 2017;188:240-4. doi: 10.1016/j.jpeds.2017.04.004
Fasano A. Physiological, pathological, and therapeutic implications of zonulin-mediated intestinal barrier modulation: Living life on the edge of the wall. Am J Pathol. 2008;173:1243-52. doi: 10.2353/ajpath.2008.080651
Julio-Pieper M, Bravo JA, Aliaga E, Gotteland M. Review article: intestinal barrier dysfunction and central nervous system disorders—a controversial association. Aliment Pharmacol Ther. 2014;40(10):1187-201. doi: 10.1111/apt. 12950
DOI: http://dx.doi.org/10.61155/gen.v79i1.729
IMÁGENES GEN
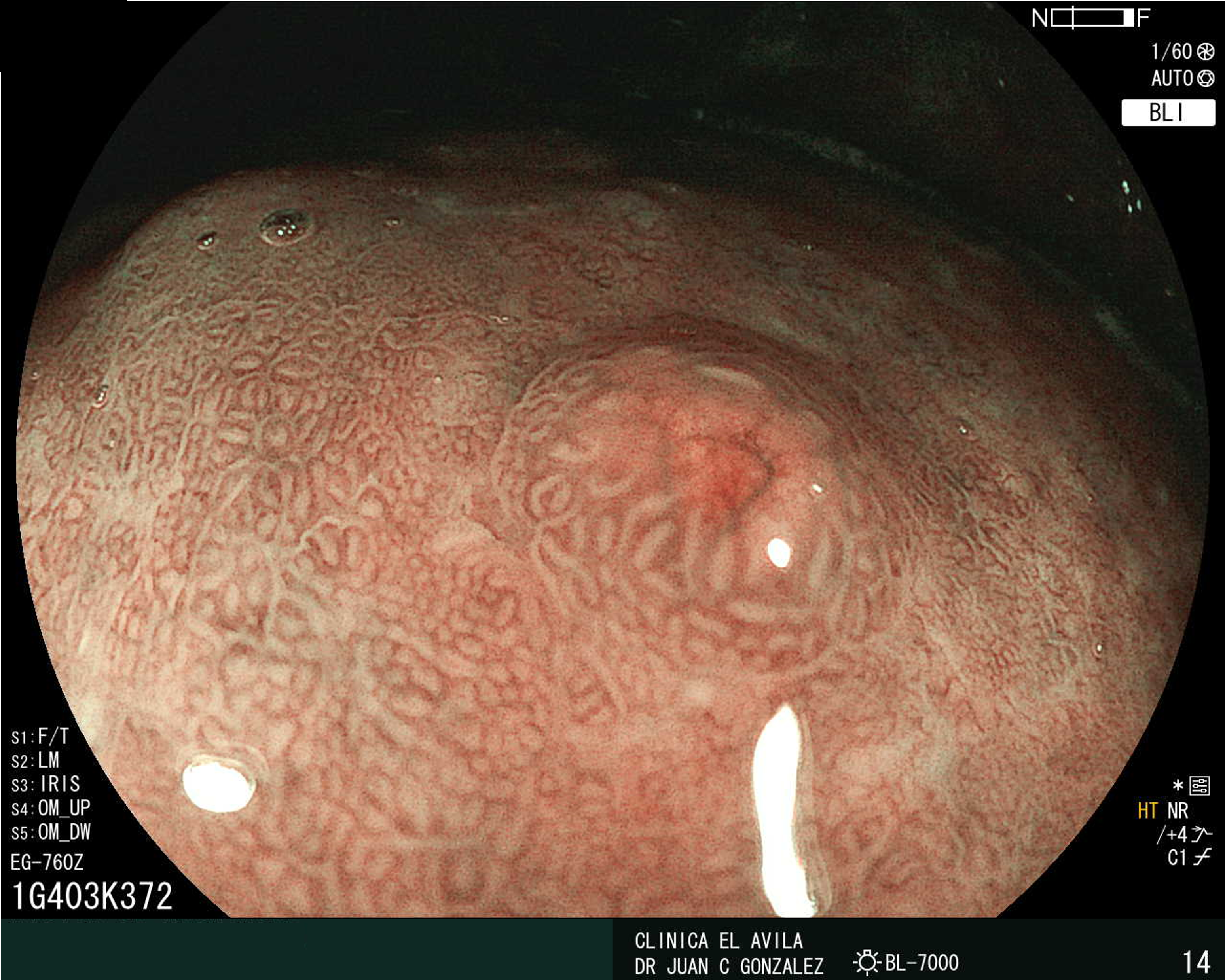
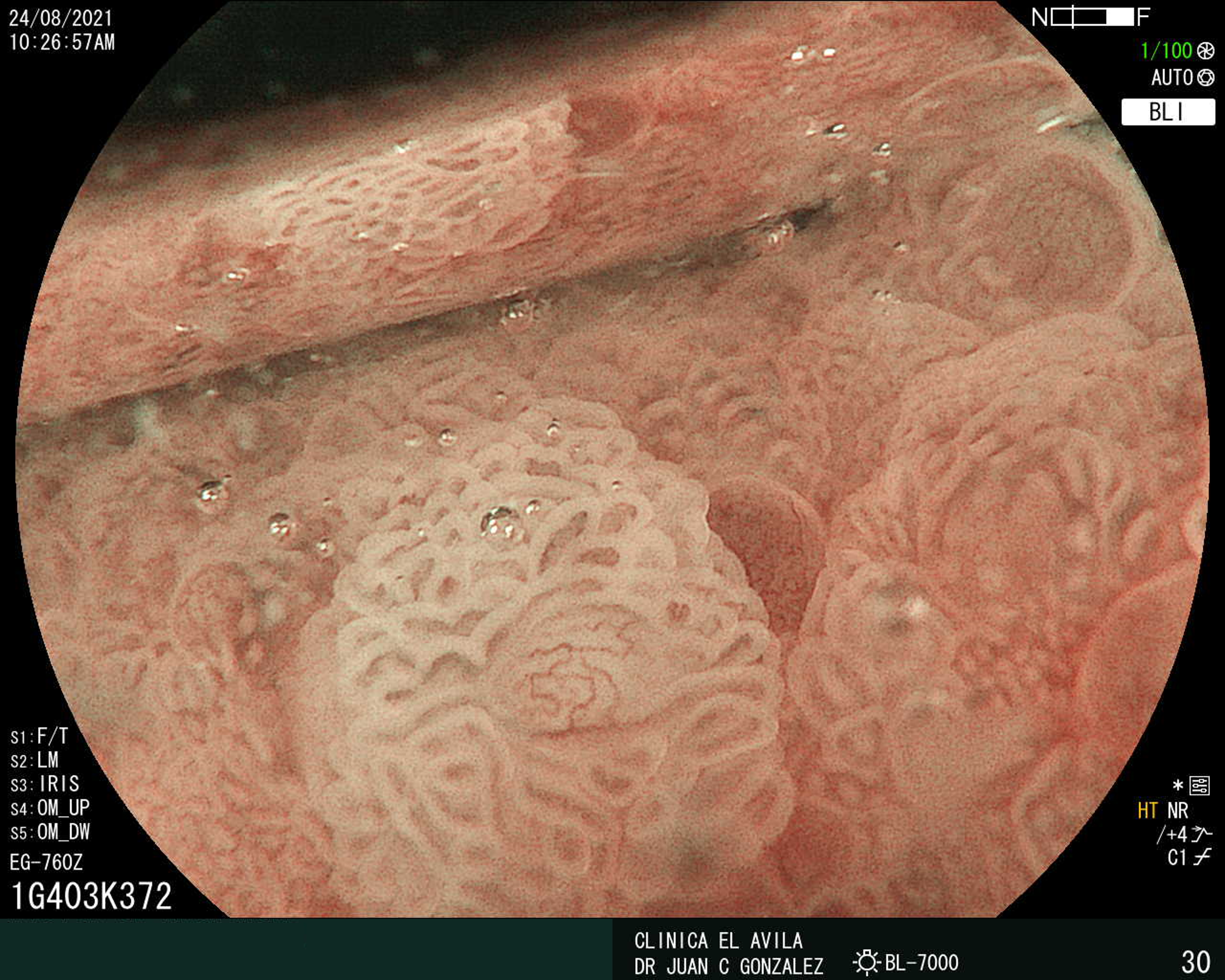
| Figura 1. Tumor Neuroendocrino Gástrico | Figura 2. Hiperplasia de Células Neuroendocrinas en estómago |
 |  |
 |  |  |
ISSN: 0016-3503 e-ISSN: 2477-975X