Comentarios acerca de: Alteraciones neuroconductuales en niños con autismo relacionadas con niveles de amonio plasmático y bacterias hidrolizantes de urea
Resumen
Comentarios acerca de: Alteraciones neuroconductuales en niños con autismo relacionadas con niveles de amonio plasmático y bacterias hidrolizantes de urea.
Publicado en GEN en el Vol. 76, número 1, enero-marzo 2022, Pag: 10-16.
Sr Editor,
He leído con gran interés el artículo publicado por Moreno, Xiomara y colaboradores: “Alteraciones neuroconductuales en niños con autismo relacionadas con niveles de amonio plasmático y bacterias hidrolizantes de urea”, encontrándolo muy atractivo y actual puesto que toca una temática que se encuentra cada vez más en auge.
De hecho, se ha venido describiendo un incremento en la prevalencia de trastornos del espectro autista (TEA) pasando de 2/10.000 a cifras que oscilan según los últimos estudios entre 2 y 6,7/1000 (1 por cada 100-500). No se sabe si ello se debe a un mayor reconocimiento de la entidad o a un verdadero incremento en su incidencia. Probablemente obedezca a una mejor clasificación de otros trastornos que afectan al lenguaje, al aprendizaje y/o se acompañan de retraso mental1,2.
Y es que es bien conocido que las personas con TEA presentan alteraciones en el neurodesarrollo que comienzan en edades precoces y se incrementan hasta la edad adulta y permanecen a lo largo de la vida con una prevalencia del 57-90%, debido a diferentes causas, en gran parte todavía desconocidas1, de allí también deriva la importancia por conocer cada vez más los factores que pudiesen estar implicados en su desarrollo.
Las investigaciones acerca del origen del autismo ponen cada vez más en evidencia que estos trastornos no responden a una única etiología. Existe un amplio consenso acerca de la influencia de los factores perinatales en el origen del autismo en donde factores de susceptibilidad genética se combinan con factores ambientales2, siendo estos los que condicionan su severidad y, de consecuencia, sus manifestaciones neurológicas o gastrointestinales. En tal sentido, se han descrito manifestaciones asociadas a síndromes tan diversos como metabolopatías, intoxicaciones o infecciones pre y postnatales, epilepsia, cuadros de discapacidad intelectual profunda, discapacidad cognitiva, ataxia y otros problemas motores, ceguera y otras alteraciones oculares, sordera, hiperactividad, ansiedad, insomnio y otros2, por lo que resulta muy complejo poder individualizar una única causa como génesis de todas las alteraciones.
Una de las teorías que cada vez presenta más auge es la de alteraciones en el eje intestino-cerebro, el cual se ha ampliado para incluir la microbiota (eje microbiota-intestino-cerebro) y hay evidencia que sugiere que las bacterias intestinales afectan al "gran cerebro"3. Se ha encontrado que la microbiota influye en los procesos neurológicos centrales, incluida la neurogénesis, la plasticidad sináptica, la señalización de neurotransmisores, el neurodesarrollo y la neuroinflamación, hallando que puede contribuir al comportamiento anormal en modelos animales seleccionados que exhiben estereotipias y deficiencias en la comunicación social4.
Las citocinas proinflamatorias circulantes (y, quizás, las moléculas derivadas de bacterias, como los lipopolisacáridos) alteran la función de la barrera hematoencefálica e inician una respuesta neuroinflamatoria. Estos efectos se ven exacerbados por los efectos proinflamatorios de una dieta deficiente (y otros factores ambientales)5 y sin duda a esta situación podemos sumar el efecto del amonio plasmático relacionado a la disbiosis.
Llama la atención que habiendo factores conocidos asociados con la composición del microbioma intestinal, tales como la dieta (personas con dietas altas en proteínas y grasas animales tienen enterotipos caracterizados por altos niveles de Bacteroides, mientras que aquellos con una dieta alta en fibra tienen enterotipos con altos niveles de Prevotella)6,7 así como las infecciones, antibióticos, drogas comunes como los IBP, metformina, inhibidores de la recaptación de serotonina, laxantes5 y otros, que pueden alterar temporalmente la composición de la microbiota intestinal, todos los pacientes del grupo control presentaron un estado de “eubiosis”. ¿Tal vez por la gran heterogeneidad entre la cohorte del estudio y el control, o podría estar relacionada al tipo de técnica empleada para el estudio de la microbiota en la muestra seleccionada? Sería interesante conocer más en detalle el procesamiento utilizado para las muestras, puesto que históricamente, los estudios de microbiota se realizaban utilizando métodos de cultivo en los que una o unas pocas especies bacterianas se aislaban y estudiaban en relación con una enfermedad, sin embargo, el desarrollo de la técnica para secuenciar el gen del ARN ribosómico 16S bacteriano permite la evaluación taxonómica general del microbioma intestinal, y más recientemente, la secuenciación aleatoria del genoma completo, o secuenciación metagenómica, se ha convertido en una poderosa metodología para estudiar el microbioma5,8. Reconociendo ante todo las limitaciones con las que cada día nos encontramos en nuestro medio y que justamente son estas limitaciones las que enaltecen la realización de trabajos como el que se presenta.
Finalmente, no queda más que felicitar al grupo de trabajo quienes a pesar de la situación actual realizan trabajos de calidad, que con su publicación nos amplían el horizonte en el conocimiento de una entidad en donde todavía queda mucho por descubrir.
Texto completo:
PDFReferencias
Hervás A, Rueda I. Alteraciones de conducta en los trastornos del espectro autista. Rev Neurol 2018; 66 (Supl 1):31-8.
Ruiz-Lázaroa, M. Posada de la Pazb, F. Hijano Banderac. Trastornos del espectro autista. Detección precoz, herramientas de cribado PM. Rev Pediatr Aten Primaria. 2009; 11 (Supl 17):381-397.
Eamonn M. M. Quigley. Microbiota-Brain-Gut Axis and Neurodegenerative Diseases Curr Neurol Neurosci Rep (2017) 17:94.
Helen E. Vuong, Jessica M. Yano, Thomas C. Fung, Elaine Y. Hsiao. The Microbiome and Host Behavior. Annu Rev Neurosci. 2017 July 25; 40: 21–49.
Weersma RK, Zhernakova A, Fu J. Interaction between drugs and the gut microbiome. Gut 2020;69:1510–1519.
Yong-Ku Kim and Cheolmin Shin. The Microbiota-Gut-Brain Axis in Neuropsychiatric Disorders: Pathophysiological Mechanisms and Novel Treatments. Microbiota-Gut-Brain Axis in Neuropsychiatric Disorders Current Neuropharmacology, 2018, Vol. 16, No. 5.
Katerina V. Johnson and Kevin R. Foster. Why does the microbiome affect behaviour? Nature Reviews. Microbiology (2018). https://doi.org/10.1038/s41579-018-0014-3
Zhu et al. The progress of gut microbiome research related to brain disorders Sibo. Journal of Neuroinflammation (2020) 17:25.
DOI: http://dx.doi.org/10.61155/gen.v76i2.613
IMÁGENES GEN
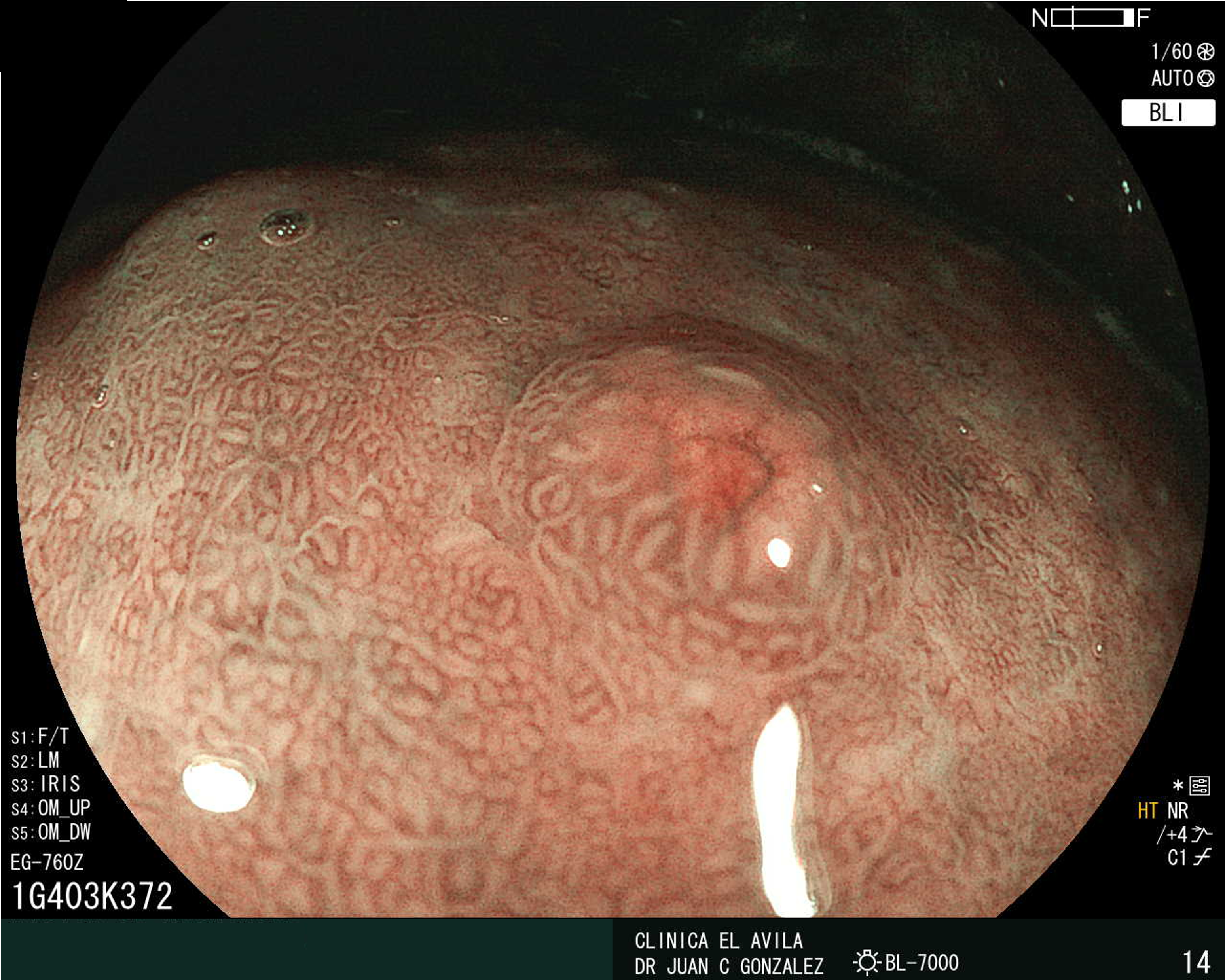
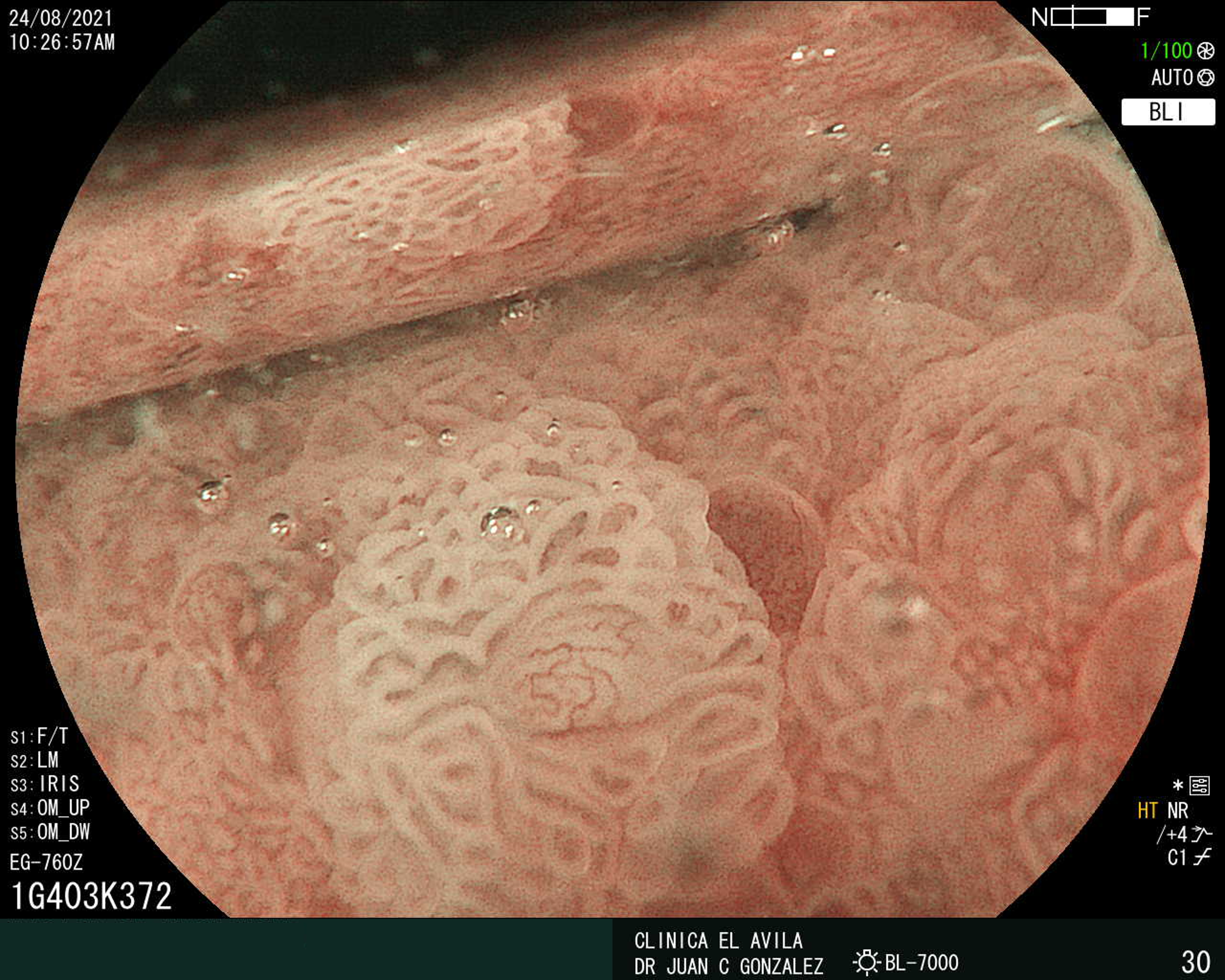
| Figura 1. Tumor Neuroendocrino Gástrico | Figura 2. Hiperplasia de Células Neuroendocrinas en estómago |
 |  |
 |  |  |
ISSN: 0016-3503 e-ISSN: 2477-975X