Alteraciones neuroconductuales en niños con autismo relacionadas con niveles de amonio plasmático y bacterias hidrolizantes de urea
Resumen
Palabras clave
Texto completo:
PDFReferencias
American Psychiatric Association. neurodevelopment disorders in: diagnostic and statistical Manual of Mental disorders, 5th edition. Washington, DC: American Psychiatric Publishing, Inc., 2014. 01.
Trating Autism, ESPA Research, Autism Tratment Plus. Comorbilidades médicas en los trastornos del espectro autista. Hinking Autism. 2014; 2da. Edición.
Urdaneta Yllen M. Relación del amonio sérico con la severidad de la encefalopatía hepática. Rev Gen. 2008; 62 (1): 44-48
Nogales A, López K, Navarro D, Rosell A, Quintana Betsabeth, Enicar P, et al. Hiperamonemia en niños: clasificación y opciones terapéuticas.Gen. 2013; 7(1):11-15.
Martins I. Una aproximación a los desórdenes hereditarios del ciclo de la urea en el hombre. Rev Biomed. 2005; 16(3):196-204.
Varela-Gonzales D, Ruiz-García M, Vela-Amieva M, Munive-Baez L, Hernández-Antúnez B. Conceptos actuales sobre la etiología del autismo. Acta Pediatr Mex. 2011; 32(4):213-222.
Enns G, Packman S. Diagnosing Inborn Errors of Metabolism in the Newborn: Laboratory Investigations. Neo Reviews. 2001; 2:192- 200.
Ortega JA, Bacarreza DV, Castillo I, Ceballos C, Mata P. Hiperamonemia como complicación en Pacientes con Síndrome de Intestino Corto. Rev Mex de Cir Ped. 2006; 13 (3):117-131.
García R, Soto A, Ortega A, Guevara P, Guillén E, Matin J, et al. Recomendaciones para la utilización de la determinación de amonio en plasma en el Laboratorio Clínico. SEQC-ML 2007; 26(5):256-264.
Moreno X, Santamaría G, Sánchez R, de la Torre B, Garcés, F, Hernández C, et al. Microbiota gastrointestinal aeróbica en niños con trastorno del espectro autista. Estudio preliminar. GEN. 2015; 69 (2):36-44.
Finegold SM, Molitoris D, Song Y, et al. Gastrointestinal microflora studies in late-onset autism. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 2002; 35(1): S6-S16.
Strati F, Cavalieri D, Albanese D, De Felice C, Donati C, Hayek J, Jousson O, Leoncini S, Renzi D, Calabrò A, De Filippo C. New evidences on the altered gut microbiota in autism spectrum disorders. Microbiome. 2017; 5(1):24.
Moreno X, Santamaria G, Sánchez R, Olivares A, Garcés Fátima, Hernández C, et al. Disbiosis aeróbica y síntomas gastrointestinales y conductuales en niños con trastorno del espectro autista. A C SVBE. 2018; 21(2): 36-44.
Chow J, Tang H, Mazmanian SK. Pathobionts of the gastrointestinal microbiota and inflammatory disease. Curr Opin Immunol. 2011; 23(4):473-80.
Garrett WS, Punit S, Gallini CA, Michaud M, Zhang D, Sigrist KS, et al. Colitis-associated colorectal cancer driven by T-bet deficiency in dendritic cells. Cancer Cell. 2009; 16(3):208-19.
Chan YK, Estaki M, Gibson DL. Clinical consequences of diet-induced dysbiosis. Ann Nutr Metab. 2013; 63(2):28-40.
Yan Q, Gu Y, Li X, Yang W, Jia L, Chen C, et al. Alterations of the Gut Microbiome in Hypertension Front Cell Infect Microbiol. 2017; 7:381.
Moreno-Calderón X, Vialva-Guerrero A, Núñez-Bello M, Macero-Esteves C, López-Barrera K, Márquez-Duque A, et al. Estudio observacional de la microbiota intestinal aeróbica. Kasmera. 2020; 48(2): e48231547.
Royero Gutiérrez HA. Enfermedad inflamatoria intestinal. Rev Col Gastroenterol. 2003; 18(1): 24-41.
Alparo Herrera I. Manifestaciones gastrointestinales de niños con espectro autista. Rev. Bol. Ped. 2013; 52(3): 165-167.
Srikantha P, Mohajeri MH. The Possible Role of the Microbiota-Gut-Brain-Axis in Autism Spectrum Disorder. Int J Mol Sci. 2019;20(9):2115.
Burrus CJ. A biochemical rationale for the interaction between gastrointestinal yeast and autism. Med Hypotheses. 2012; 79(6):784-5.
Auron A, Brophy PD. Hyperammonemia in review: pathophysiology, diagnosis, and treatment. Pediatr Nephrol. 2012; 27(2):207-22.
Filipek PA, Juranek J, Nguyen MT, Cummings C, Gargus JJ. Relative carnitine deficiency in autism. J Autism Dev Disord. 2004; 34(6):615-23.
Saleem TH, Shehata GA, Toghan R, Sakhr HM, Bakri AH, Desoky T, et al. Assessments of Amino Acids, Ammonia and Oxidative Stress Among Cohort of Egyptian Autistic Children: Correlations with Electroencephalogram and Disease Severity. Neuropsychiatr Dis Treat. 2020; 16:11-24.
Hassan MH, Desoky T, Sakhr HM, Gabra RH, Bakri AH. Possible Metabolic Alterations among Autistic Male Children: Clinical and Biochemical Approaches. J Mol Neurosci. 2019;67(2):204-216.
Ming X, Stein TP, Barnes V, Rhodes N, Guo L. Metabolic perturbance in autism spectrum disorders: a metabolomics study. J Proteome Res. 2012; 11(12):5856-62.
Fallon JM, Feltenstein R. Use of lactulose in the treatment of Autism. Patent Application Publication: US 2008/0058282 A1. Mar. 6, 2008. United States.
Fallon J. Could one of the most widely prescribed antibiotics amoxicillin/clavulanate “augmentin” be a risk factor autism. Medical Hypotheses. 2005; 64: 312-315..
Sánchez C, Goméz N, Quintero J. Producción de ácido clavulánico por fermentación Streptomyces clavuligerus: evaluación de diferentes medios de cultivos y modelo matemático. Dyna. 2012; 175: 158-165.
Etchepareborda M. Tratamiento de los niños con electroencefalograma paroxístico sin crisis. Rev Neurol. 2003; 37:293-297.
DOI: http://dx.doi.org/10.61155/gen.v76i1.607
IMÁGENES GEN
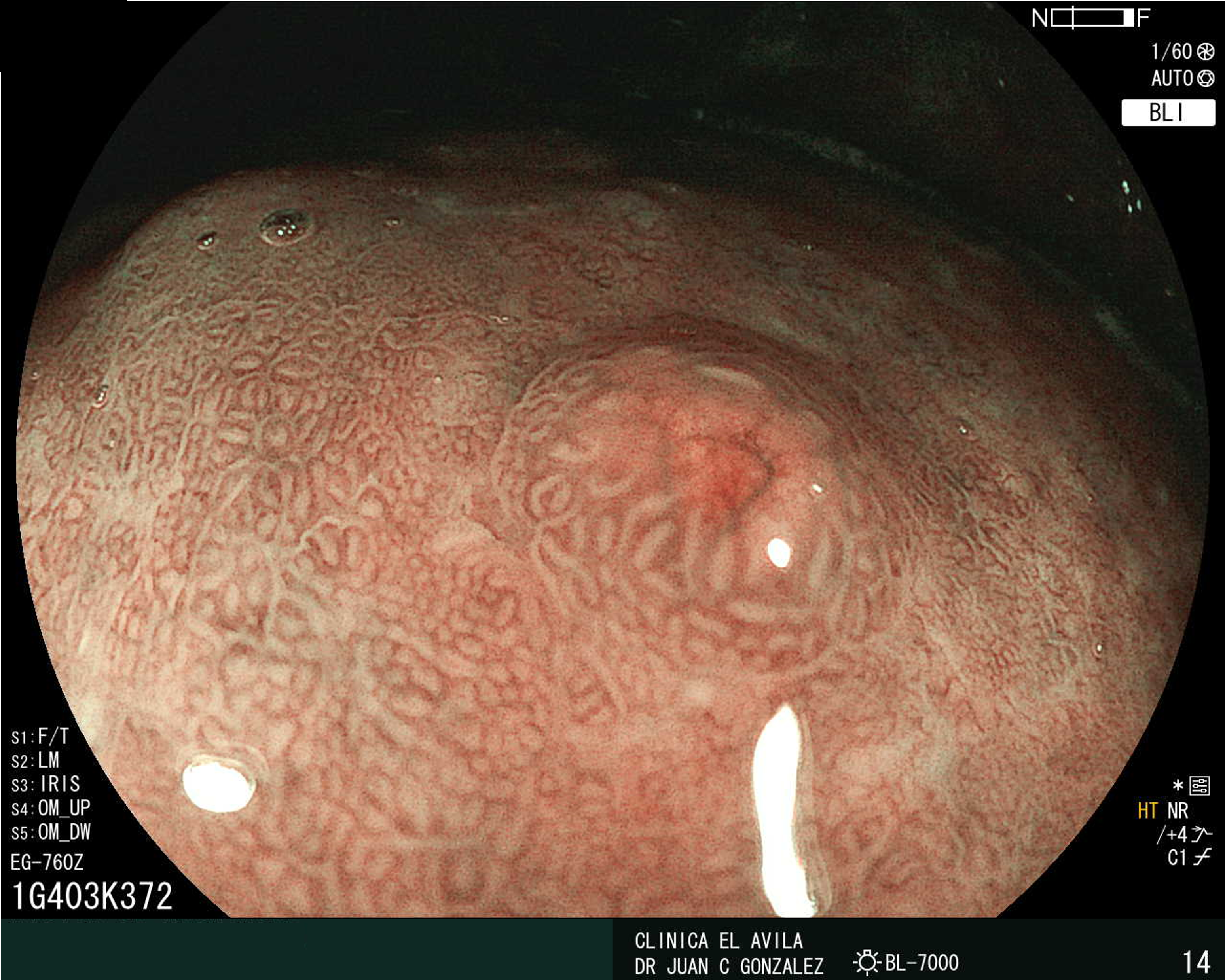
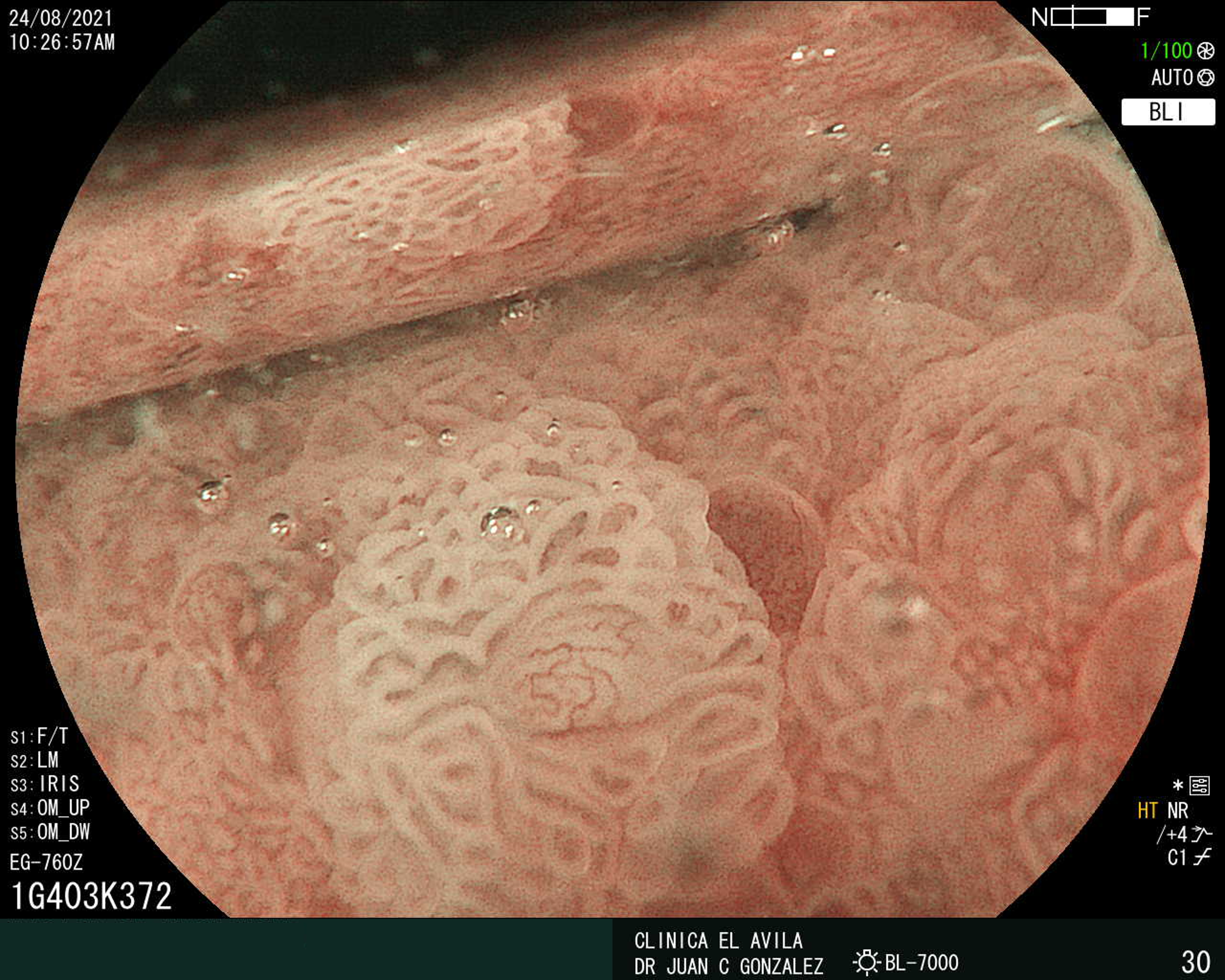
| Figura 1. Tumor Neuroendocrino Gástrico | Figura 2. Hiperplasia de Células Neuroendocrinas en estómago |
 |  |
 |  |  |
ISSN: 0016-3503 e-ISSN: 2477-975X