Unión Escamo Columnar y Metaplasia Intestinal en Esófago: Magnificación y FICE
Resumen
El esófago de Barrett (EB) es una complicación del reflujo crónico gastroesofágico y es considerado el principal factor de riesgo para el desarrollo de displasia y adenocarcinoma. Es por ello que, en los últimos años, se ha desarrollado especial interés sobre el papel de la endoscopia en el diagnóstico y tratamiento de la displasia de alto grado y el cáncer asociado a EB.
La principal dificultad comienza por tener un diagnóstico adecuado, y en este punto desafortunadamente existen fallas y contradicciones que van desde el diagnóstico mismo de EB, ya que la apariencia endoscópica no es suficiente, adicional al hecho que el endoscopista debe identificar adecuadamente la unión esofagogástrica, la unión escamocolumnar y obtener biopsias adecuadas. Así mismo, se necesita la confirmación histológica de la presencia de metaplasia intestinal especializada en el esófago distal. El diagnóstico histológico también confronta problemas ya que lamentablemente aún existen discrepancias entre patólogos expertos gastrointestinales, en la identificación de metaplasia intestinal especializada y si a su vez presenta displasia de alto grado.
Trataremos ahora las dificultades diagnósticas desde el punto de vista endoscópico y las herramientas con las que contamos los endoscopistas para identificar EB. Con el advenimiento de los videoendoscopios de alta resolución (> 800.000 pixeles) es posible detectar con certeza al menos 80% de las lesiones displásicas o neoplásicas en EB. Sin embargo, para lograr esto, es necesaria la observación meticulosa de anormalidades sutiles y utilizar la Clasificación de Praga, para referirse a la extensión del tejido metaplásico. Si se identifica una lesión se debe catalogar según el Consenso de París.
Los protocolos de seguimiento en los pacientes con EB recomiendan endoscopias periódicas con toma de biopsias en cada uno de los cuadrantes del esófago a intervalos de 1 o 2 cm y de las alteraciones visibles como nódulos o úlceras (Protocolo de Seattle). La DAG y el adenocarcinoma precoz no son visibles habitualmente en las endoscopias convencionales e identificarlos puede ser difícil a pesar de seguir protocolos rigurosos en la toma de biopsias. Se han evaluado o están en proceso de evaluación diversos métodos para identificar con mayor seguridad la metaplasia intestinal, la displasia y el adenocarcinoma en el EB. El valor potencial de estas técnicas diagnósticas de imágenes está en la posibilidad de examinar en su totalidad el segmento de Barrett, con el fin de identificar la displasia, sin necesidad de tomar biopsias, o de facilitar su toma selectiva en áreas que probablemente contienen epitelio displásico.
Las técnicas de diagnóstico por la imagen pueden identificar el epitelio de Barrett tanto por la naturaleza absortiva de sus células como por la magnificación de la imagen, hasta alcanzar una resolución que permita poner de manifiesto su estructura glandular y detectar mínimas alteraciones en su superficie indicativas de displasia.
Para mejorar la visualización de las lesiones puede utilizarse irrigación con agua o ácido acético(AA) como fue descrito por Guelrud y colaboradores quienes distinguieron con esta técnica 4 tipos de patrones de la superficie mucosa y 2 de ellos (III: patrón velloso; IV: patrón distorsionado) tuvieron un alto valor predictivo (el 87 frente al 100%, respectivamente) para la metaplasia intestinal. No se dispone de información relevante sobre la aplicación del AA para el diagnóstico de la displasia y el adenocarcinoma precoz en el EB.
El uso de colorantes como el azul de metileno o índigo carmín no ha incrementado la detección de displasia de alto grado o cáncer, pero sí permite una mejor demarcación de estas lesiones, los resultados son controvertidos, y su precisión diagnóstica está reducida en los pacientes con esofagitis concomitante. El azul de metileno es menos sensible para detectar la displasia que el Protocolo de Seattle.
Los equipos de alta resolución actualmente en uso, disponen de modos adicionales para mejorar la imagen tales como NBI (Narrow Band Imaging), FICE (Fuji Intelligent Color Enhancement), i-Scan (imagen Enhancement), los cuales, si bien no mejoran la detección de lesiones neoplásicas, sí admiten una mejor visualización y caracterización de las mismas, lo cual es muy importante para la ulterior realización de terapéutica endoscópica.
La imagen de banda estrecha (NBI) es una técnica endoscópica de alta resolución que utiliza filtros ópticos adicionales que permiten la transmisión de la luz azul, mientras que eliminan las luces de otras longitudes de onda. La profundidad de la penetración de la luz depende de su longitud de onda y la luz azul de 475 nm penetra sólo superficialmente el tejido y permite, por una parte, la mejor visión de la morfología de la mucosa sin el uso de colorantes y, por otra, al ser absorbida por la hemoglobina, pone de manifiesto la distribución vascular. Sharma y colaboradores definieron tres patrones de la mucosa en pacientes con EB: estriado/velloso, circular e irregular/distorsionado y dos patrones vasculares: normal y anormal. Los mismos autores encontraron que el patrón estriado/velloso tenía una relación significativa con el EB sin DAG, mientras que los patrones irregular/distorsionado y vasculares anormales tenían relación con el EB con DAG. Kara y colaboradores21 han descrito que el patrón mucoso irregular o desestructurado, el patrón vascular irregular y los vasos sanguíneos anormales fueron factores predictivos independientes de la DAG. La endoscopia de alta resolución (EAR) seguida de NBI es equivalente, en sus resultados, a la EAR seguida de cromoendoscopia con índigo carmín (el 86 frente al 93%, respectivamente) para la detección de DAG o adenocarcinoma precoz en el EB.
Diversos estudios clínicos donde se tienen como premisa el disminuir el número de biopsias, evitar los errores de muestreo implementan la magnificación endoscópica combinada o no con ácido acético para dirigir las áreas blanco, dentro de los trabajos más recientes se cuenta con los de Ferguson y colaboradores donde se mostró la variación interobservador en la identificación de la unión escamocolumnar, los criterios publicados para la identificación de metaplasia intestinal especializada (MIE) usando endoscopia con magnificación y realce con AA están asociados con un alto nivel de concordancia entre observadores. De los 4 tipos de patrones descritos, encontraron mejor exactitud entre los observadores con el patrón tipo IV. Esta variabilidad interobservador puede limitar la aplicabilidad de este tipo de técnica en el diagnóstico de MIE que endoscópicamente luce como esófago de Barrett. y la comparación de la toma de biopsias al azar o dirigidas por magnificación donde el campo de las biopsias al azar fue discretamente menor sin diferencia estadísticamente significativa entre ambas metodologías.
En la actualidad se continua en busca de la unificación de criterios y clasificaciones que puedan ser validadas, extrapoladas y ampliamente utilizadas en el ámbito de la gastroenterología, en tal sentido, la clasificación propuesta y mencionada en el trabajo del Dr. Piñero sobre los patrones glandulares y la forma de la unión escamocolumnar descritas por Toyoda y Wallner, que requieren de mayor número de trabajos e investigadores para su validación e implementación en la práctica diaria.
En conclusión, el diagnóstico de esófago de Barrett no es fácil, se necesita un examen cuidadoso, utilizar equipos de alta resolución y medios que realcen la visión endoscópica, para detectar adecuadamente las lesiones y en estrecho contacto con el patólogo, con la finalidad de llegar a un diagnóstico preciso y decidir terapéutica endoscópica.
Texto completo:
PDFReferencias
Haggitt RC, et al. Barrett´s esophagus. Correlation between mucin histochemistry, flow cytometry, and histologic diagnosis for predicting increased cancer risk. Hum Pathol 1994;25:982.
Spechler SJ. The columnar-lined esophagus, intestinal metaplasia, and Norman Barrett. Gastroenterology 1996;110:614-21.
Hamilton SR, et al. The relationship between columnar epithelial dysplasia and invasive adenocarcinoma arising in Barretts esophagus. Am J Clin Pathol 1987;87:301-12.
Ronald W Yeh, George Triadafilopoulos. Endoscopy Therapy for Barretts Esophagus. Gastrointest Endoscopy Clin N Am 2005;15:377-397.
Vieth M, Schubert B, et al. Frequency of Barrett neoplasia after initial negative endoscopy with biopsy: a long-term histopathological follow-up study. Endoscopy 2006;38:1201-1207.
Wang KK, Sampliner RE. Practice Parameters Committee ACG: Update guidelines 2008 for the diagnosis, surveillance and therapy of Barretts esophagus. Am J Gastroenterol 2008;103:788-797.
EII C, May A, Gossner L, et al. Endoscopic mucosal resection of early cancer and high grade dysplasia in Barretts esophagus. Gastroenterology 2000;115:670-677.
Montgomery EA. Biopsy interpretation of the Gastrointestinal Tract Mucosa. Lippincot Williams & Wilkings; 2006.
The Paris Endoscopic Classification of superficial neoplastic lesions: Esophagus, Stomach and Colon: November 30 and December 1, 2002. Gastrointest Endosc 2003;58:S3-S43.
Reid, et al. Observer variations in the diagnosis of Displasia in Barretts esophagus. Human Pathology 1998;19:166-78.
Montgomery EA. Reproducity of the diagnosis of Displasia in Barretts esophagus. A reaffirmation. Human Pathology 2001; 32:368-78.
Sharma P, Dent J, Armstrong D, et al. The development and validation of an endoscopic grading system for Barretts Esophagus: The Prague C and M criteria. Gastroenterology 2006;131: 1392-1399.
Levine DS, Haggitt RC, Blount PL, Rabinovitch PS, Rusch VW, Reid BJ. An endoscopy biopsy protocol can differentiate high- grade dysplasia from early adenocarcinoma in Barretts esophagus. Gastroenterology 1993;105:40-50.
Guelrud M, Herrera I. Acetic acid improves identification of remnant islands of Barretts epithelium after endoscopic therapy. Gastrointest Endosc 1998;47:512-5.
Canto MI, Setrakian S, Willis J, Chak A, Petras R, Powe NR, et al. Methylene blue-directed biopsies improve detection of intestinal metaplasia and dysplasia in Barretts esophagus. Gastrointest Endosc. 2000;51:560-8.
Sharma P, Topalovski M, Mayo MS, Weston AP. Methylene blue chromoendoscopy for detection of short-segment Barretts esophagus. Gastrointest Endosc. 2001;54:289-93. 18.
Canto MI, Setrakian S, Willis JE, Chak A, Petras RE, Sivak MV. Methylene blue staining of dysplastic and nondysplastic Barretts esophagus: an in vivo and ex vivo study. Endoscopy. 2001;33:391-400. 19.
Kiesslich R, Hahn M, Herrmann G, Jung M. Screening for specialized columnar epithelium with methylene blue: chro- moendoscopy in patients with Barretts esophagus and a normal control group. Gastrointest Endosc. 2001;53:47-52. 20.
Lim CH, Rotimi O, Dexter SP, Axon AT. Randomized crossover study that used methylene blue or random 4-quadrant biopsy for the diagnosis of dysplasia in Barretts esophagus. Gastrointest Endosc. 2006;64:195-9.
Gono K, Obi T, Yamaguchi M, Ohyama N, Machida H, Sano Y, et al. Appearance of enhanced tissue features in narrow-band endoscopic imaging. J Biomed Opt. 2004;9:568-77. 28.
Kara MA, Ennahachi M, Fockens P, Ten Kate FJ, Bergman JJ. Detection and classification of the mucosal and vascular patterns (mucosal morphology) in Barretts esophagus by using narrow band imaging. Gastrointest Endosc. 2006;64:155-66. 29.
Hamamoto Y, Endo T, Nosho K, Arimura Y, Sato M, Imai K. Usefulness of narrow-band imaging endoscopy for diagnosis of Barretts esophagus. J Gastroenterol. 2004;39:14-20. 30.
Sharma P, Bansal A, Mathur S, Wani S, Cherian R, McGregor D, et al. The utility of a novel narrow band imaging endoscopy system in patients with Barretts esophagus. Gastrointest Endosc. 2006;64:167-75. 31.
Sharma P, Marcon N, Wani S, Bansal A, Mathur S, Sampliner R, et al. Non-biopsy detection of intestinal metaplasia and dysplasia in Barretts esophagus: a prospective multicenter study. Endoscopy. 2006;38:1206-12. 32.
Kara MA, Peters FP, Rosmolen WD, Krishnadath KK, Ten Kate FJ, Fockens P, et al. High-resolution endoscopy plus chro- moendoscopy or narrow-band imaging in Barretts esopha- gus: a prospective randomized crossover study. Endoscopy 2005;37:929-36.
Ferguson D, DeVault K, Loeb D, Wallace M. Inter-Observer Variability with Enhanced Magnification Endoscopy of the Squamocolumnar Junction. Gastrointest Endosc. 2005;61:T1:335, AB225.
Ferguson D, DeVault K, Loeb D, Kirshna M, Wallace M. Enhanced Magnification Directed Biopsies for Detection of Intestinal Metaplasia in Patients with GERD. Gastrointest Endosc. 2005;61:T1336, AB225.
DOI: http://dx.doi.org/10.61155/gen.v66i1.176
IMÁGENES GEN
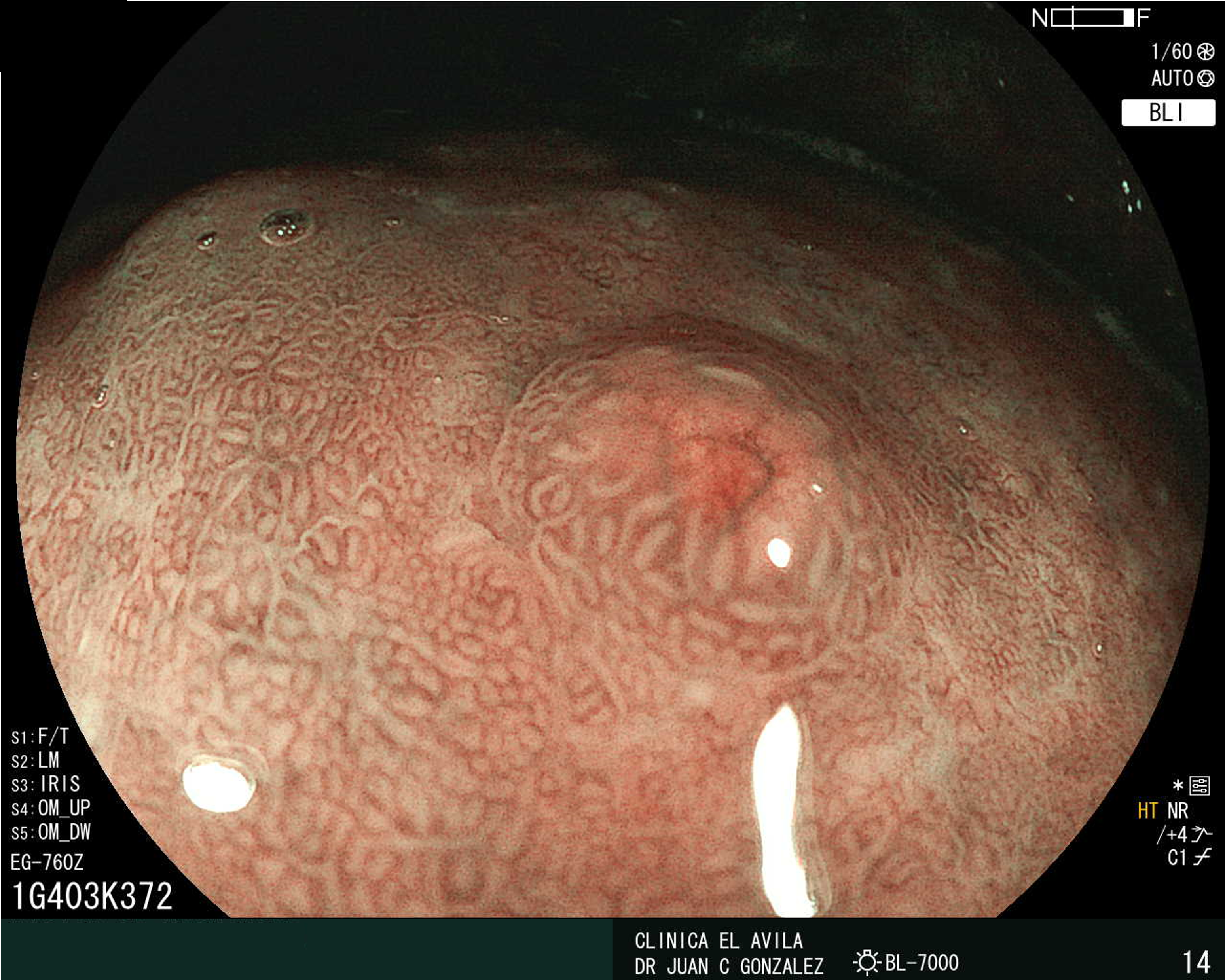
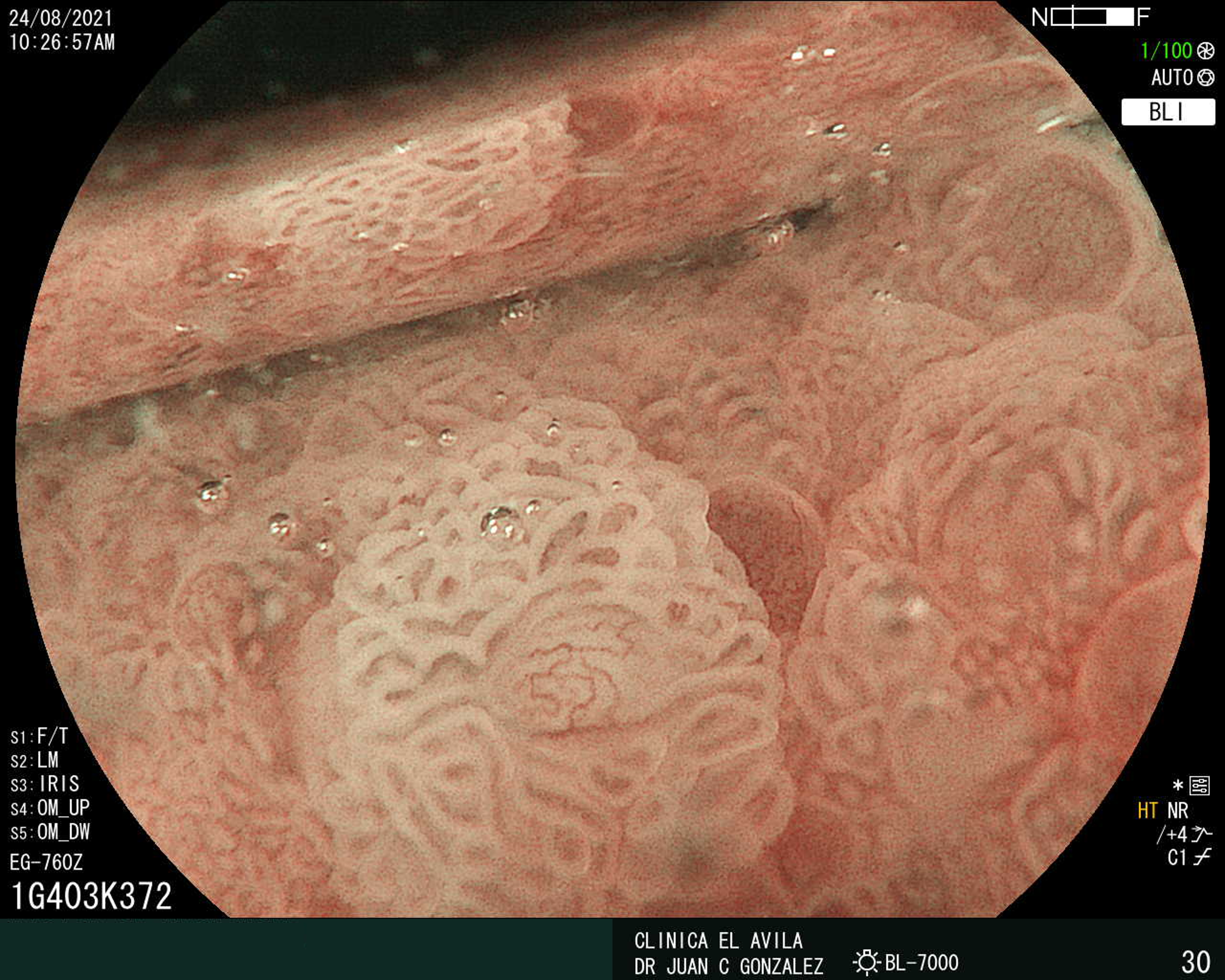
| Figura 1. Tumor Neuroendocrino Gástrico | Figura 2. Hiperplasia de Células Neuroendocrinas en estómago |
 |  |
 |  |  |
ISSN: 0016-3503 e-ISSN: 2477-975X