Evaluación inmunológica de extractos de Ascaris Lumbricoides para las inmunoglobulinas IgA en el suero de individuos infectados
Resumen
Introducción: El parásito Ascaris lumbricoides es el más grande de los nemátodos que parasita el intestino humano. En Venezuela, la infección por Ascaris lumbricoides es la geohelmintiasis de mayor importancia en zonas rurales, por su alta frecuencia y morbilidad. La infección estimula una respuesta de anticuerpos IgA, sin embargo se conoce poco sobre las proteínas responsables de la respuesta para este isotipo. La identificación de estas proteínas podría ayudar al diseño de pruebas para el diagnóstico y la detección en el medio ambiente o en individuos expuestos a este parásito. Nuestro trabajo se basó en identificar proteínas antigénicas en extractos y fracciones de A. lumbricoides para la respuesta especifica IgA en el suero de niños infectados.
Materiales y métodos: Fueron evaluados 85 sueros de niños de ambos sexo entre 3 y 14 años de edad, de comunidades rurales del Estado Miranda. Los niños fueron clasificados según el resultado coprológico en tres grupos, Ascaris positivos en heces; Ascaris negativos con otras parasitosis y un grupo libre de parásitos en heces. Las proteínas fueron identificadas por Western Blot y el nivel de anticuerpos IgA medidos por ELISA.
Resultados: Se detectaron en el extracto de A. lumbricoides un mínimo de 17 proteínas con pesos moleculares de entre 26 y 205 KDa aproximadamente, siendo reconocidas por el suero de los niños infectados proteínas de 205, 148, 95, 75 y 45KDa.
Conclusiones: El presente trabajo permitió medir los niveles de anticuerpos específicos IgA anti-Ascaris e identificar las proteínas responsables de la respuesta IgA.
Immunological evaluation of extracts of ascaris lumbricoides for IgA immunoglobulins in serum of infected individuals
Summary
Introduction: The parasite Ascaris lumbricoides is the largest nematode parasitizing the human intestine. In Venezuela, infection with Ascaris lumbricoides is the most important STH in rural areas, because of its high frequency and morbidity. Infection stimulates an antibody IgA response, however little is known about the proteins responsible for this isotype. The identification of these proteins could aid the design of tests for the diagnosis and detection in the environment or individuals exposed to this parasite. Our work was based on the identification of antigenic proteins in extracts and fractions of A. lumbricoides for specifi c IgA antibody response in serum of infected children. Materials and Methods: A total of 85 sera from children (boys and girls) between 3 and 14 years old, from rural communities in Miranda State. Children were classifi ed according to the stool results in three groups, Ascaris positive in stool; negative for Ascaris, but with other parasites and a group no parasites in feces. Proteins were detected by Western blotting and the IgA antibody levels measured by ELISA. Results: We detected in the extract of A. lumbricoides at least 17 proteins with molecular weights of between 26 and 205 kDa and were recognized by the sera of infected children, proteins of 205, 148, 95, 75 and 45kDa children. Conclusions: This study allowed us to measure the levels of specific IgA anti-Ascaris and identify the proteins responsible of this response.
Key words: Ascaris lumbricoides, Immunoglobulin A, electroforesis, extract, ELISA, Western Blot, immunologic response.
Fecha de recepción: 30 de octubre de 2013. Fecha de revisión: 28 de enero de 2014. Fecha de aprobación: 7 de abril de 2014.
Introducción
La Ascariasis es una infección cuyo agente etiológico es el parásito llamado Ascaris lumbricoides (del griego Askarís, que significa gusano) y el cual es el más grande de los nemátodos que parasita el intestino humano. Un parásito es un organismo que se beneficia de otro al obtener los nutrientes de los tejidos vivos del hospedador, sin daño tisular o muerte del hospedador. En la mayoría de los casos, los parásitos dañan o causan enfermedades al organismo hospedador.1 Es transmitida por vía oral a través del consumo de agua o alimentos contaminados con huevos del parásito y afecta a una gran parte de la población especialmente en las zonas tropicales y subtropicales del planeta, específicamente en las zonas en donde las condiciones ambientales (temperatura y humedad) y socioeconómicas son favorables para el desarrollo del parásito y la transmisión de la enfermedad. Se presenta en personas de todas las edades pero es más común en niños debido a sus hábitos de juegos al aire libre a nivel del suelo.2 La ascariasis intestinal es considerada como una de las diez infecciones parasitarias más comunes en el mundo, calculándose que existen entre 800 y mil millones de individuos infectados con Ascaris lumbricoides; aunque la mortalidad es relativamente baja, las complicaciones frecuentemente requieren de atención hospitalaria.3 En Venezuela, la infección por Ascaris lumbricoides es la geohelmintiasis de mayor importancia en salud pública, por su alta frecuencia, morbilidad y la determinación de complicaciones graves.4 Según el Ministerio de Salud y Desarrollo Social, entre 1990 y 2002, en nuestro país prevaleció una tasa del 49,25% de helmintiasis, aproximadamente, identificando las especies como: Trichuris trichiura 25,82%, Ascaris lumbricoides 5,75% y Necator americanus en menor proporción.5 La infección estimula una respuesta de anticuerpo IgA, sin embargo se conoce poco sobre las proteínas responsables de esta respuesta. Es por ello, que nos planteamos la identificación de las proteínas asociadas a la respuesta IgA anti-Ascaris que permitan la detección del parásito en el medio ambiente.
Pacientes y Métodos
La muestra estuvo conformada por 85 niños pertenecientes a las comunidades de El Marqués, Los Médanos, La Peica, El Guapo y El Teleférico, todas del Edo. Miranda en edades comprendidas entre 3 y 14 años. Este trabajo fue aprobado por el comité de Bioética del Instituto de Inmunología de la UCV.
Diagnóstico parasitológico
La detección de individuos infectados con Ascaris lumbricoides se realizó mediante el examen de heces por el método de Kato para la observación directa de huevos en el microscopio.11 Los individuos fueron clasificados según su diagnóstico parasitológico en: a) Pacientes positivos en heces con Ascaris lumbricoides (Asc.+); b) Pacientes con otras parasitosis sin Ascaris lumbricoides (Asc- OP+); c) Individuos a los cuales no se le detectaron parásitos en las heces (NSOP).
Preparación del extracto de A. lumbricoides
La preparación del extracto de Ascaris lumbricoides fue realizada por lisis mecánica en PBS con Tritón X-100 al 0.5%. Luego de la lisis, el homogenato fue centrifugado a 1200 Xg durante 10 minutos a 4°C. El sobrenadante fue recuperado y filtrado en membranas de 0,22μm para la obtención de un extracto soluble. La determinación de la concentración de proteínas totales fue realizada por el método de Lowry.8
Obtención de fracciones del extracto de A. lumbricoides por centrifugación diferencial
Las fracciones fueron obtenidas a partir del homogenato soluble del gusano adulto de A. lumbricoides por centrifugación diferencial. El homogenato fue centrifugado inicialmente a 252 Xg durante 5 minutos a 4°C, para obtener el primer sedimento (Fracción 1), luego el sobrenadante fue centrifugado nuevamente a 504 Xg por 10 min a 4ºC para obtener el segundo sedimento (Fracción 2). El sobrenadante fue centrifugado por tercera vez a 1.680 Xg por 10 min a 4ºC para la (Fracción 3). Finalmente, el sobrenadante restante fue centrifugado a 2.352 Xg por 10 min a 4ºC para generar el cuarto sedimento (Fracción 4).
Análisis del extracto por electroforesis en geles de poliacrilamida El análisis del extracto se realizó mediante electroforesis en geles de poliacrilamida al 10%.10 El extracto fue colocado a 30μg/pista y migrado a 100 voltios a temperatura ambiente. Para visualizar las proteínas el gel fue teñido con azul de Coomasie. Los pesos moleculares de las proteínas identificadas fueron estimadas a partir de la comparación con proteínas de pesos moleculares (PM) conocidos.
Respuesta de anticuerpos IgA anti-Ascaris por ELISA Para medir la respuesta de anticuerpos IgA contra las proteínas de Ascaris lumbricoides se utilizó la técnica de ELISA9, cual fue estandarizada en nuestro laboratorio. El extracto de Ascaris lumbricoides fue acoplado en placas de 96 pozos a una concentración de 5μg/pozo en PBS pH 7,2 e incubada por 1 hora a 37°C. Las placas fueron lavadas con PBS y bloqueadas en PBS-Leche descremada al 2% e incubadas 1 hora a 37°C. Luego, fueron incubados los sueros de los individuos infectados y los controles diluidos a 1:50 en PBS-Tween 20 0,1% a 4°C toda la noche. Las placas fueron lavadas 3 veces con PBS-Tween 20 0,1% por 10 min y subsecuentemente, estas fueron incubadas con anti-IgA humana (SIGMA ALDRICH®) acoplada a peroxidasa y diluida 1:750 en PBS-Tween 20 0,1% durante 1h a 37°C. Las placas fueron lavadas 4 veces con PBS-Tween 20 0,1% por 10 min y reveladas con Tetrametilbenzidina (TMB) agregando 100μL/pozo e incubando durante 10 minutos en la oscuridad. La reacción fue detenida con 50μl de H2SO4 1N. La placa fue leida en un lector de ELISA (SUNRISE serie 801000880) con el programa Magellan Tecan V 6.4 a 450 nm. El valor del punto de corte fue determinado del promedio de las densidades ópticas de 20 individuos no infectados más o menos 2 veces el valor de la desviación estándar.
Identificación de proteínas reactivas para la respuesta IgA anti-Ascaris por inmunodetección
Para la identificación de proteínas antigénicas del extracto soluble y las fracciones, de A. lumbricoides, estas fueron separadas por electroforesis y transferidas a papel de nitrocelulosa 0,45μm para la identifi cación del isotipo IgA por Western Blot.7 Las membranas fueron bloqueadas con PBS-Leche descremada 1% durante 1 hora a temperatura ambiente, en agitación constante. Las membranas fueron lavadas con PBS-Tween 20 0,1% durante 10 minutos. Incubadas con un pool de sueros de niños infectados o no, diluidos 1:50 en PBS-Tween 20 0,1% toda la noche en agitación constante. Las membranas fueron lavadas 3 veces con PBS-Tween 20 0,1% durante 10 minutos cada uno en agitación constante. Las membranas fueron incubadas con el anticuerpo secundario anti-IgA humano acoplado a peroxidasa (SIGMA ALDRICH®) en una dilución 1:750 en solución PBS-Tween 20 0,1% durante 1:30 horas en agitación constante y a temperatura ambiente. Las membranas fueron lavadas 4 veces con PBS-Tween 20 0,1% durante 10 minutos en agitación constante. El revelado se realizó con un kit comercial de 3,3',5,5'-Tetrametilbenzidina (TMB) para la visualización de las proteínas. Finalmente, se procedió a fotografiar las membranas para digitalizarlas.
Análisis estadístico
Se utilizó estadística descriptiva de datos tales como: media, desviación estándar, frecuencia y porcentaje. Para el análisis de los resultados obtenidos en el inmunoensayo ELISA, se utilizó el Programa Estadístico MedCalc (MedCalc Statistical Software) 9.3.0.0. La comparación de los promedios entre los grupos, fue realizado por (U de Manwhitney) con un intervalo de confi anza del 95% y se consideró estadísticamente signifi cativa un valor p <0,05.
Resultados
Epidemiología
La muestra estudiada estuvo conformada por 85 pacientes pertenecientes a las comunidades de El Marqués, Los Médanos, La Peica, El Guapo y El Teleférico, todas del Edo. Miranda, cuyas muestras de heces fueron analizadas en la cátedra de parasitología de la escuela de medicina José María Vargas de la UCV. La distribución de los individuos evaluados fue de: 27 individuos pertenecían a la comunidad de El Teleférico. 33 individuos pertenecían a la comunidad de los Médanos, 7 pertenecían a la comunidad de El Marqués, 9 pertenecían a la comunidad de El Guapo y 9 pertenecían a la comunidad de la Peica (Cuadro 1).
Análisis bioquímico del extracto Los resultados obtenidos a partir de la electroforesis en geles de poliacrilamida al 10% y su posterior tinción con azul de Coomassie mostraron un mínimo de 17 proteínas visibles de distintos pesos moleculares entre 26 y 205 kDa (Figura 1). Las proteínas que más se destacaron fueron las de: 205 kDa, 148 kDa, 75 kDa, 45 kDa y 32 kDa respectivamente.
Determinación de los niveles de anticuerpos IgA anti- Ascaris
Se realizó la técnica de ELISA utilizando como antígeno el extracto de un gusano hembra de A. lumbricoides, se calculó el promedio de densidades ópticas (D.O) leídas a 450 nanómetros de los individuos de cada grupo y se obtuvo un promedio general por grupo más o menos la desviación estándar. Al analizar los niveles de anticuerpos IgA anti-Ascaris mediante ELISA para cada uno de los grupos de estudio, se observó que los niveles de IgA para el grupo de A. lumbricoides positivos eran significativamente mayores (p<0,05) en comparación a los otros dos grupos estudiados (Cuadro 2). Sin embargo, no se encontró diferencia estadísticamente signifi cativa cuando se compararon los niveles de anticuerpos del grupo no infectado con respecto al grupo de individuos A. lumbricoides negativos con otras parasitosis positivos. Para el grupo de individuos A. lumbricoides positivos, se observó un promedio de D.O de 0,39 + 0,06; mientras que el grupo no infectados el promedio fue de 0,17 + 0,06. Los valores de este grupo fueron utilizados para obtener el valor del punto de corte (cut-off) que correspondió un valor de 0,17 + 0.06. En el grupo de individuos A. lumbricoides negativos y con otras parasitosis, se observó un promedio de D.O de 0,22 + 0,07 (Cuadro 2).
Seroprevalencia de A. lumbricoides para la respuesta IgA La seroprevalencia frente al extracto de A. lumbricoides fue del 59% en el grupo de individuos infectados por A. lumbricoides según el análisis coproparasitológico (27/85). El grupo de niños negativos para Ascaris, pero con otras parasitosis mostró un valor de seroprevalencia de (41%).
Identificación de antígenos para la respuesta IgA anti-Ascaris en las fracciones
La identificación de proteínas inmunogénicas para la respuesta de anticuerpos IgA anti-Ascaris, se muestra en laFigura 2 panel A y B, se muestran los resultados de un pool de pacientes seropositivos por ELISA y presencia de huevos en las heces para el extracto y las diferentes fracciones, donde fueron reconocidas principalmente proteínas de 205 kDa, 148 kDa, 95 kDa, 75 kDa, 45 kDa y 32 kDa respectivamente (Figura 3). Se observaron diferencias en la reactividad en cada fracción. Por ejemplo se observó mayor reactividad en el extracto, la fracción 2 y la fracción 4, siendo las proteínas más reactivas las de 205 kDa y 148 kDa respectivamente (Figuras 2 y 3). Mientras que el suero de individuos negativos en heces y seronegativos en ELISA no reaccionaron a ninguna proteína (Figuras 3 y 4).
Niveles de anticuerpos IgA contra extractos de A. lumbricoides en niños de comunidades del estado Miranda por ELISA. Asc: A. lumbricoides positivos. NSOP: negativos en heces. Asc -OP+: A. lumbricoides negativos con otras parasitosis.
Reconocimiento de bandas antigénicas correspondientes a proteínas del extracto y las fracciones de pesos moleculares de 50, 55, 75, 95, 130,148 y 205 kDa en el suero de individuos infectados. PM: Peso molecular de referencia. Ext: Extracto del parásito. F: Fracción.1, 2, 3,y 4.(3A). Reactividad de individuos negativos en heces para Ascaris lumbricoides y clasifi cados como seronegativos mediante la técnica inmunológica de ELISA.
Discusión
El parásito Ascaris lumbricoides es el más grande de los nemátodos que parasita el intestino humano. En Venezuela, la infección por Ascaris lumbricoides es la geohelmintiasis de mayor importancia, por su alta frecuencia y morbilidad.1 Se sabe que la infección por A. lumbricoides estimula una respuesta de anticuerpos, sin embargo, no existen estudios que se hayan llevado a cabo para evaluar la capacidad antigénica de extractos de Ascaris lumbricoides y la producción de anticuerpos contra dichas estructuras y principalmente la estimulación de la respuesta inmunológica por la Inmunoglobulina A que se produce en la mucosa intestinal con el propósito de detener la infección.8 Por lo tanto, se propuso en el presente trabajo de investigación, a determinar si hay una respuesta de anticuerpos IgA en el suero de individuos que habitan zonas rurales contra las proteínas de los extractos de A. lumbricoides3 y la identifi cación de proteínas asociados con la respuesta IgA específica.
En los experimentos previamente señalados se observó y se demostró la reactividad de los sueros de los pacientes seropositivos mediante la técnica de ELISA frente a distintas proteínas inmunogénicas presentes en el extracto de Ascaris lumbricoides, en los cuales se reconocieron proteínas comunes para ambos grupos de sueros de los pacientes seropositivos que desarrollaron anticuerpos de tipo IgA fue del 59%. El resto de los individuos estuvo por debajo del punto de corte, tal vez debido a una exposición reciente del parásito o a que la edad era muy baja. Las proteínas reconocidas por los individuos infectados fueron de 205 kDa, y 148 kDa y también en menor proporción las de 75 kDa, 50 kDa, 45 kDa. En este sentido es la primera vez que se reportan proteínas específicas para la respuesta de anticuerpo IgA anti-Ascaris. Asimismo, se demostró la especificidad de la respuesta de anticuerpos ya que no hubo reactividad en los sueros de los individuos no infectados hacia los extractos o las fracciones demostrados como seronegativos mediante la técnica de ELISA. El resultado de la técnica de ELISA demostró que la infección por A. lumbricoides estimula una respuesta de anticuerpos especifico de tipo IgA. Se desprende que existe diferencia significativa diferencia cuando se compara los niveles de anticuerpos del grupo (Asc+) versus el grupo de individuos no infectados ni los individuos no infectados por Ascaris, pero si con otra parasitosis intestinal.
Por otra parte, las campañas de desparasitación de manera indiscriminada que se realizan en zonas rurales donde las infecciones helmínticas son endémicas, siendo probable que esos individuos hayan sido tratados con antihelmínticos antes de la realización de este estudio sin haber recibido tratamiento para protozoarios.6 La infección por Ascaris lumbricoides estimula una respuesta inmunológica de tipo IgA en los individuos infectados (seropositivos), sin embargo un porcentaje importante de los individuos a los cuales no se les detectaron huevos en las heces, presentaron seropositividad en ELISA (% porcentaje), indicando una posible exposición previa al parásito. Estos resultados demuestran que esta técnica tiene la capacidad para detectar los individuos infectados. Lo que podría sugerir que dicha inmunoglobulina tiene una alta probabilidad de ser detectada no solo a nivel de la mucosa intestinal, donde su respuesta prevalece incluso después de haber erradicado la infección, sino además a nivel sistémico. En cuanto a la reactividad se pudo observar el reconocimiento de proteínas principalmente de 205, 148 y 75 KDa en el grupo de pacientes seropositivos para IgA frente a los extractos de A. lumbricoides en comparación a los individuos no infectados. Estas tres proteínas fueron reconocidas en ambos experimentos (Figuras 2 y 3), en los que utilizamos sueros de distintos pacientes donde observamos que hubo respuesta significativa a las fracciones, sobre todo a la fracción 2 y 4. Estas proteínas podrían ser utilizadas como antígenos candidatos en modelos de pruebas serológicas que permitan complementar el diagnóstico y seroprevalencia de la Ascariasis en poblaciones con baja o mediana carga parasitaria. Esta es la primera vez que se reportan proteínas específicas para la respuesta de anticuerpo IgA anti-Ascaris. Asimismo, no hubo reactividad en los sueros de los individuos no infectados y demostrados como seronegativos mediante la técnica de ELISA.
Immunological evaluation of extracts of ascaris lumbricoides for IgA immunoglobulins in serum of infected individuals
Summary
Introduction: The parasite Ascaris lumbricoides is the largest nematode parasitizing the human intestine. In Venezuela, infection with Ascaris lumbricoides is the most important STH in rural areas, because of its high frequency and morbidity. Infection stimulates an antibody IgA response, however little is known about the proteins responsible for this isotype. The identification of these proteins could aid the design of tests for the diagnosis and detection in the environment or individuals exposed to this parasite. Our work was based on the identification of antigenic proteins in extracts and fractions of A. lumbricoides for specifi c IgA antibody response in serum of infected children. Materials and Methods: A total of 85 sera from children (boys and girls) between 3 and 14 years old, from rural communities in Miranda State. Children were classifi ed according to the stool results in three groups, Ascaris positive in stool; negative for Ascaris, but with other parasites and a group no parasites in feces. Proteins were detected by Western blotting and the IgA antibody levels measured by ELISA. Results: We detected in the extract of A. lumbricoides at least 17 proteins with molecular weights of between 26 and 205 kDa and were recognized by the sera of infected children, proteins of 205, 148, 95, 75 and 45kDa children. Conclusions: This study allowed us to measure the levels of specific IgA anti-Ascaris and identify the proteins responsible of this response.
Key words: Ascaris lumbricoides, Immunoglobulin A, electroforesis, extract, ELISA, Western Blot, immunologic response.
Fecha de recepción: 30 de octubre de 2013. Fecha de revisión: 28 de enero de 2014. Fecha de aprobación: 7 de abril de 2014.
Introducción
La Ascariasis es una infección cuyo agente etiológico es el parásito llamado Ascaris lumbricoides (del griego Askarís, que significa gusano) y el cual es el más grande de los nemátodos que parasita el intestino humano. Un parásito es un organismo que se beneficia de otro al obtener los nutrientes de los tejidos vivos del hospedador, sin daño tisular o muerte del hospedador. En la mayoría de los casos, los parásitos dañan o causan enfermedades al organismo hospedador.1 Es transmitida por vía oral a través del consumo de agua o alimentos contaminados con huevos del parásito y afecta a una gran parte de la población especialmente en las zonas tropicales y subtropicales del planeta, específicamente en las zonas en donde las condiciones ambientales (temperatura y humedad) y socioeconómicas son favorables para el desarrollo del parásito y la transmisión de la enfermedad. Se presenta en personas de todas las edades pero es más común en niños debido a sus hábitos de juegos al aire libre a nivel del suelo.2 La ascariasis intestinal es considerada como una de las diez infecciones parasitarias más comunes en el mundo, calculándose que existen entre 800 y mil millones de individuos infectados con Ascaris lumbricoides; aunque la mortalidad es relativamente baja, las complicaciones frecuentemente requieren de atención hospitalaria.3 En Venezuela, la infección por Ascaris lumbricoides es la geohelmintiasis de mayor importancia en salud pública, por su alta frecuencia, morbilidad y la determinación de complicaciones graves.4 Según el Ministerio de Salud y Desarrollo Social, entre 1990 y 2002, en nuestro país prevaleció una tasa del 49,25% de helmintiasis, aproximadamente, identificando las especies como: Trichuris trichiura 25,82%, Ascaris lumbricoides 5,75% y Necator americanus en menor proporción.5 La infección estimula una respuesta de anticuerpo IgA, sin embargo se conoce poco sobre las proteínas responsables de esta respuesta. Es por ello, que nos planteamos la identificación de las proteínas asociadas a la respuesta IgA anti-Ascaris que permitan la detección del parásito en el medio ambiente.
Pacientes y Métodos
La muestra estuvo conformada por 85 niños pertenecientes a las comunidades de El Marqués, Los Médanos, La Peica, El Guapo y El Teleférico, todas del Edo. Miranda en edades comprendidas entre 3 y 14 años. Este trabajo fue aprobado por el comité de Bioética del Instituto de Inmunología de la UCV.
Diagnóstico parasitológico
La detección de individuos infectados con Ascaris lumbricoides se realizó mediante el examen de heces por el método de Kato para la observación directa de huevos en el microscopio.11 Los individuos fueron clasificados según su diagnóstico parasitológico en: a) Pacientes positivos en heces con Ascaris lumbricoides (Asc.+); b) Pacientes con otras parasitosis sin Ascaris lumbricoides (Asc- OP+); c) Individuos a los cuales no se le detectaron parásitos en las heces (NSOP).
Preparación del extracto de A. lumbricoides
La preparación del extracto de Ascaris lumbricoides fue realizada por lisis mecánica en PBS con Tritón X-100 al 0.5%. Luego de la lisis, el homogenato fue centrifugado a 1200 Xg durante 10 minutos a 4°C. El sobrenadante fue recuperado y filtrado en membranas de 0,22μm para la obtención de un extracto soluble. La determinación de la concentración de proteínas totales fue realizada por el método de Lowry.8
Obtención de fracciones del extracto de A. lumbricoides por centrifugación diferencial
Las fracciones fueron obtenidas a partir del homogenato soluble del gusano adulto de A. lumbricoides por centrifugación diferencial. El homogenato fue centrifugado inicialmente a 252 Xg durante 5 minutos a 4°C, para obtener el primer sedimento (Fracción 1), luego el sobrenadante fue centrifugado nuevamente a 504 Xg por 10 min a 4ºC para obtener el segundo sedimento (Fracción 2). El sobrenadante fue centrifugado por tercera vez a 1.680 Xg por 10 min a 4ºC para la (Fracción 3). Finalmente, el sobrenadante restante fue centrifugado a 2.352 Xg por 10 min a 4ºC para generar el cuarto sedimento (Fracción 4).
Análisis del extracto por electroforesis en geles de poliacrilamida El análisis del extracto se realizó mediante electroforesis en geles de poliacrilamida al 10%.10 El extracto fue colocado a 30μg/pista y migrado a 100 voltios a temperatura ambiente. Para visualizar las proteínas el gel fue teñido con azul de Coomasie. Los pesos moleculares de las proteínas identificadas fueron estimadas a partir de la comparación con proteínas de pesos moleculares (PM) conocidos.
Respuesta de anticuerpos IgA anti-Ascaris por ELISA Para medir la respuesta de anticuerpos IgA contra las proteínas de Ascaris lumbricoides se utilizó la técnica de ELISA9, cual fue estandarizada en nuestro laboratorio. El extracto de Ascaris lumbricoides fue acoplado en placas de 96 pozos a una concentración de 5μg/pozo en PBS pH 7,2 e incubada por 1 hora a 37°C. Las placas fueron lavadas con PBS y bloqueadas en PBS-Leche descremada al 2% e incubadas 1 hora a 37°C. Luego, fueron incubados los sueros de los individuos infectados y los controles diluidos a 1:50 en PBS-Tween 20 0,1% a 4°C toda la noche. Las placas fueron lavadas 3 veces con PBS-Tween 20 0,1% por 10 min y subsecuentemente, estas fueron incubadas con anti-IgA humana (SIGMA ALDRICH®) acoplada a peroxidasa y diluida 1:750 en PBS-Tween 20 0,1% durante 1h a 37°C. Las placas fueron lavadas 4 veces con PBS-Tween 20 0,1% por 10 min y reveladas con Tetrametilbenzidina (TMB) agregando 100μL/pozo e incubando durante 10 minutos en la oscuridad. La reacción fue detenida con 50μl de H2SO4 1N. La placa fue leida en un lector de ELISA (SUNRISE serie 801000880) con el programa Magellan Tecan V 6.4 a 450 nm. El valor del punto de corte fue determinado del promedio de las densidades ópticas de 20 individuos no infectados más o menos 2 veces el valor de la desviación estándar.
Identificación de proteínas reactivas para la respuesta IgA anti-Ascaris por inmunodetección
Para la identificación de proteínas antigénicas del extracto soluble y las fracciones, de A. lumbricoides, estas fueron separadas por electroforesis y transferidas a papel de nitrocelulosa 0,45μm para la identifi cación del isotipo IgA por Western Blot.7 Las membranas fueron bloqueadas con PBS-Leche descremada 1% durante 1 hora a temperatura ambiente, en agitación constante. Las membranas fueron lavadas con PBS-Tween 20 0,1% durante 10 minutos. Incubadas con un pool de sueros de niños infectados o no, diluidos 1:50 en PBS-Tween 20 0,1% toda la noche en agitación constante. Las membranas fueron lavadas 3 veces con PBS-Tween 20 0,1% durante 10 minutos cada uno en agitación constante. Las membranas fueron incubadas con el anticuerpo secundario anti-IgA humano acoplado a peroxidasa (SIGMA ALDRICH®) en una dilución 1:750 en solución PBS-Tween 20 0,1% durante 1:30 horas en agitación constante y a temperatura ambiente. Las membranas fueron lavadas 4 veces con PBS-Tween 20 0,1% durante 10 minutos en agitación constante. El revelado se realizó con un kit comercial de 3,3',5,5'-Tetrametilbenzidina (TMB) para la visualización de las proteínas. Finalmente, se procedió a fotografiar las membranas para digitalizarlas.
Análisis estadístico
Se utilizó estadística descriptiva de datos tales como: media, desviación estándar, frecuencia y porcentaje. Para el análisis de los resultados obtenidos en el inmunoensayo ELISA, se utilizó el Programa Estadístico MedCalc (MedCalc Statistical Software) 9.3.0.0. La comparación de los promedios entre los grupos, fue realizado por (U de Manwhitney) con un intervalo de confi anza del 95% y se consideró estadísticamente signifi cativa un valor p <0,05.
Resultados
Epidemiología
La muestra estudiada estuvo conformada por 85 pacientes pertenecientes a las comunidades de El Marqués, Los Médanos, La Peica, El Guapo y El Teleférico, todas del Edo. Miranda, cuyas muestras de heces fueron analizadas en la cátedra de parasitología de la escuela de medicina José María Vargas de la UCV. La distribución de los individuos evaluados fue de: 27 individuos pertenecían a la comunidad de El Teleférico. 33 individuos pertenecían a la comunidad de los Médanos, 7 pertenecían a la comunidad de El Marqués, 9 pertenecían a la comunidad de El Guapo y 9 pertenecían a la comunidad de la Peica (Cuadro 1).
Análisis bioquímico del extracto Los resultados obtenidos a partir de la electroforesis en geles de poliacrilamida al 10% y su posterior tinción con azul de Coomassie mostraron un mínimo de 17 proteínas visibles de distintos pesos moleculares entre 26 y 205 kDa (Figura 1). Las proteínas que más se destacaron fueron las de: 205 kDa, 148 kDa, 75 kDa, 45 kDa y 32 kDa respectivamente.
Determinación de los niveles de anticuerpos IgA anti- Ascaris
Se realizó la técnica de ELISA utilizando como antígeno el extracto de un gusano hembra de A. lumbricoides, se calculó el promedio de densidades ópticas (D.O) leídas a 450 nanómetros de los individuos de cada grupo y se obtuvo un promedio general por grupo más o menos la desviación estándar. Al analizar los niveles de anticuerpos IgA anti-Ascaris mediante ELISA para cada uno de los grupos de estudio, se observó que los niveles de IgA para el grupo de A. lumbricoides positivos eran significativamente mayores (p<0,05) en comparación a los otros dos grupos estudiados (Cuadro 2). Sin embargo, no se encontró diferencia estadísticamente signifi cativa cuando se compararon los niveles de anticuerpos del grupo no infectado con respecto al grupo de individuos A. lumbricoides negativos con otras parasitosis positivos. Para el grupo de individuos A. lumbricoides positivos, se observó un promedio de D.O de 0,39 + 0,06; mientras que el grupo no infectados el promedio fue de 0,17 + 0,06. Los valores de este grupo fueron utilizados para obtener el valor del punto de corte (cut-off) que correspondió un valor de 0,17 + 0.06. En el grupo de individuos A. lumbricoides negativos y con otras parasitosis, se observó un promedio de D.O de 0,22 + 0,07 (Cuadro 2).
Seroprevalencia de A. lumbricoides para la respuesta IgA La seroprevalencia frente al extracto de A. lumbricoides fue del 59% en el grupo de individuos infectados por A. lumbricoides según el análisis coproparasitológico (27/85). El grupo de niños negativos para Ascaris, pero con otras parasitosis mostró un valor de seroprevalencia de (41%).
Identificación de antígenos para la respuesta IgA anti-Ascaris en las fracciones
La identificación de proteínas inmunogénicas para la respuesta de anticuerpos IgA anti-Ascaris, se muestra en laFigura 2 panel A y B, se muestran los resultados de un pool de pacientes seropositivos por ELISA y presencia de huevos en las heces para el extracto y las diferentes fracciones, donde fueron reconocidas principalmente proteínas de 205 kDa, 148 kDa, 95 kDa, 75 kDa, 45 kDa y 32 kDa respectivamente (Figura 3). Se observaron diferencias en la reactividad en cada fracción. Por ejemplo se observó mayor reactividad en el extracto, la fracción 2 y la fracción 4, siendo las proteínas más reactivas las de 205 kDa y 148 kDa respectivamente (Figuras 2 y 3). Mientras que el suero de individuos negativos en heces y seronegativos en ELISA no reaccionaron a ninguna proteína (Figuras 3 y 4).
Niveles de anticuerpos IgA contra extractos de A. lumbricoides en niños de comunidades del estado Miranda por ELISA. Asc: A. lumbricoides positivos. NSOP: negativos en heces. Asc -OP+: A. lumbricoides negativos con otras parasitosis.
Reconocimiento de bandas antigénicas correspondientes a proteínas del extracto y las fracciones de pesos moleculares de 50, 55, 75, 95, 130,148 y 205 kDa en el suero de individuos infectados. PM: Peso molecular de referencia. Ext: Extracto del parásito. F: Fracción.1, 2, 3,y 4.(3A). Reactividad de individuos negativos en heces para Ascaris lumbricoides y clasifi cados como seronegativos mediante la técnica inmunológica de ELISA.
Discusión
El parásito Ascaris lumbricoides es el más grande de los nemátodos que parasita el intestino humano. En Venezuela, la infección por Ascaris lumbricoides es la geohelmintiasis de mayor importancia, por su alta frecuencia y morbilidad.1 Se sabe que la infección por A. lumbricoides estimula una respuesta de anticuerpos, sin embargo, no existen estudios que se hayan llevado a cabo para evaluar la capacidad antigénica de extractos de Ascaris lumbricoides y la producción de anticuerpos contra dichas estructuras y principalmente la estimulación de la respuesta inmunológica por la Inmunoglobulina A que se produce en la mucosa intestinal con el propósito de detener la infección.8 Por lo tanto, se propuso en el presente trabajo de investigación, a determinar si hay una respuesta de anticuerpos IgA en el suero de individuos que habitan zonas rurales contra las proteínas de los extractos de A. lumbricoides3 y la identifi cación de proteínas asociados con la respuesta IgA específica.
En los experimentos previamente señalados se observó y se demostró la reactividad de los sueros de los pacientes seropositivos mediante la técnica de ELISA frente a distintas proteínas inmunogénicas presentes en el extracto de Ascaris lumbricoides, en los cuales se reconocieron proteínas comunes para ambos grupos de sueros de los pacientes seropositivos que desarrollaron anticuerpos de tipo IgA fue del 59%. El resto de los individuos estuvo por debajo del punto de corte, tal vez debido a una exposición reciente del parásito o a que la edad era muy baja. Las proteínas reconocidas por los individuos infectados fueron de 205 kDa, y 148 kDa y también en menor proporción las de 75 kDa, 50 kDa, 45 kDa. En este sentido es la primera vez que se reportan proteínas específicas para la respuesta de anticuerpo IgA anti-Ascaris. Asimismo, se demostró la especificidad de la respuesta de anticuerpos ya que no hubo reactividad en los sueros de los individuos no infectados hacia los extractos o las fracciones demostrados como seronegativos mediante la técnica de ELISA. El resultado de la técnica de ELISA demostró que la infección por A. lumbricoides estimula una respuesta de anticuerpos especifico de tipo IgA. Se desprende que existe diferencia significativa diferencia cuando se compara los niveles de anticuerpos del grupo (Asc+) versus el grupo de individuos no infectados ni los individuos no infectados por Ascaris, pero si con otra parasitosis intestinal.
Por otra parte, las campañas de desparasitación de manera indiscriminada que se realizan en zonas rurales donde las infecciones helmínticas son endémicas, siendo probable que esos individuos hayan sido tratados con antihelmínticos antes de la realización de este estudio sin haber recibido tratamiento para protozoarios.6 La infección por Ascaris lumbricoides estimula una respuesta inmunológica de tipo IgA en los individuos infectados (seropositivos), sin embargo un porcentaje importante de los individuos a los cuales no se les detectaron huevos en las heces, presentaron seropositividad en ELISA (% porcentaje), indicando una posible exposición previa al parásito. Estos resultados demuestran que esta técnica tiene la capacidad para detectar los individuos infectados. Lo que podría sugerir que dicha inmunoglobulina tiene una alta probabilidad de ser detectada no solo a nivel de la mucosa intestinal, donde su respuesta prevalece incluso después de haber erradicado la infección, sino además a nivel sistémico. En cuanto a la reactividad se pudo observar el reconocimiento de proteínas principalmente de 205, 148 y 75 KDa en el grupo de pacientes seropositivos para IgA frente a los extractos de A. lumbricoides en comparación a los individuos no infectados. Estas tres proteínas fueron reconocidas en ambos experimentos (Figuras 2 y 3), en los que utilizamos sueros de distintos pacientes donde observamos que hubo respuesta significativa a las fracciones, sobre todo a la fracción 2 y 4. Estas proteínas podrían ser utilizadas como antígenos candidatos en modelos de pruebas serológicas que permitan complementar el diagnóstico y seroprevalencia de la Ascariasis en poblaciones con baja o mediana carga parasitaria. Esta es la primera vez que se reportan proteínas específicas para la respuesta de anticuerpo IgA anti-Ascaris. Asimismo, no hubo reactividad en los sueros de los individuos no infectados y demostrados como seronegativos mediante la técnica de ELISA.
Palabras clave
Referencias
Markell E; Voge M; John T. Parasitología Médica. Sexta Edición. Madrid, España: Editorial Interamericana; 1994.,162-165.
Figuera L. Helmintología Básica. Primera Edición. Caracas, Editorial Gráfica León S.R.L; 1997., 85-86.
Escalante H, Liñan R, Díaz E, Davelois K, Huamanchay O. Antígenos de larvas pulmonares de Ascaris suum reconocidos por anticuerpos producidos en Oryctolagus cuniculus, Parasitología latinoamericana 2005; volumen 60(3-4):132-137.
Lynch N, Hagel I, Palenque M, et al. Relationship between helminthic infection and IgE response in atopic and nonatopic children in a tropical environment. J. Allergy Clin. Immunol. 1998; 101(2 Pt 1):217-21.
Rodríguez L, González C, Flores L, Jimenez-Zamudio L, Graniel J, Ortiz R. Assessment by fl ow cytometry of cytokine production in malnourished children. Clin. Diagn. Lab. Immunol. 2005; Volumen 12(4): 502-7.
Rodríguez O, Ortíz D, Cavazza Ma, Lopez E, Hagel I. Evaluación de la posible asociación entre la presencia de parásitos intestinales y Helicobacter pylori en población infantil de la etnia Warao, Venezuela. Boletín de Malariología y Salud Ambiental 2011; Volumen 51(1):41-48.
Mahmood T, Yang P-C. Western Blot: Technique, Theory, and Trouble Shooting. North American Journal Of Medical Sciences 2012; 4(9):429-434.
Lowry OH, Rosenbrough NJ, Farr AL, Randall RJ. Protein measurement with the Follin Phenol Reagent. J Biol Chem 1951; 193: 265-275.
Coligan, J.E. et al. (Eds), Current Protocols in Immunology. John Wiley & Sons, (New York, 1991), 2.1.10
Laemmli (1970). Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature 227, 680 – 685.
Glinz D, Silué KD, Knopp S, Lohourignon LK, Yao KP, et al. "Comparing Diagnostic Accuracy of Kato-Katz, Koga Agar Plate, Ether-Concentration, and FLOTAC for Schistosoma mansoni and Soil-Transmitted Helminths". PLoS Neglected Tropical Diseases 2010; 4(7): e754.
DOI: http://dx.doi.org/10.61155/gen.v68i2.104
IMÁGENES GEN
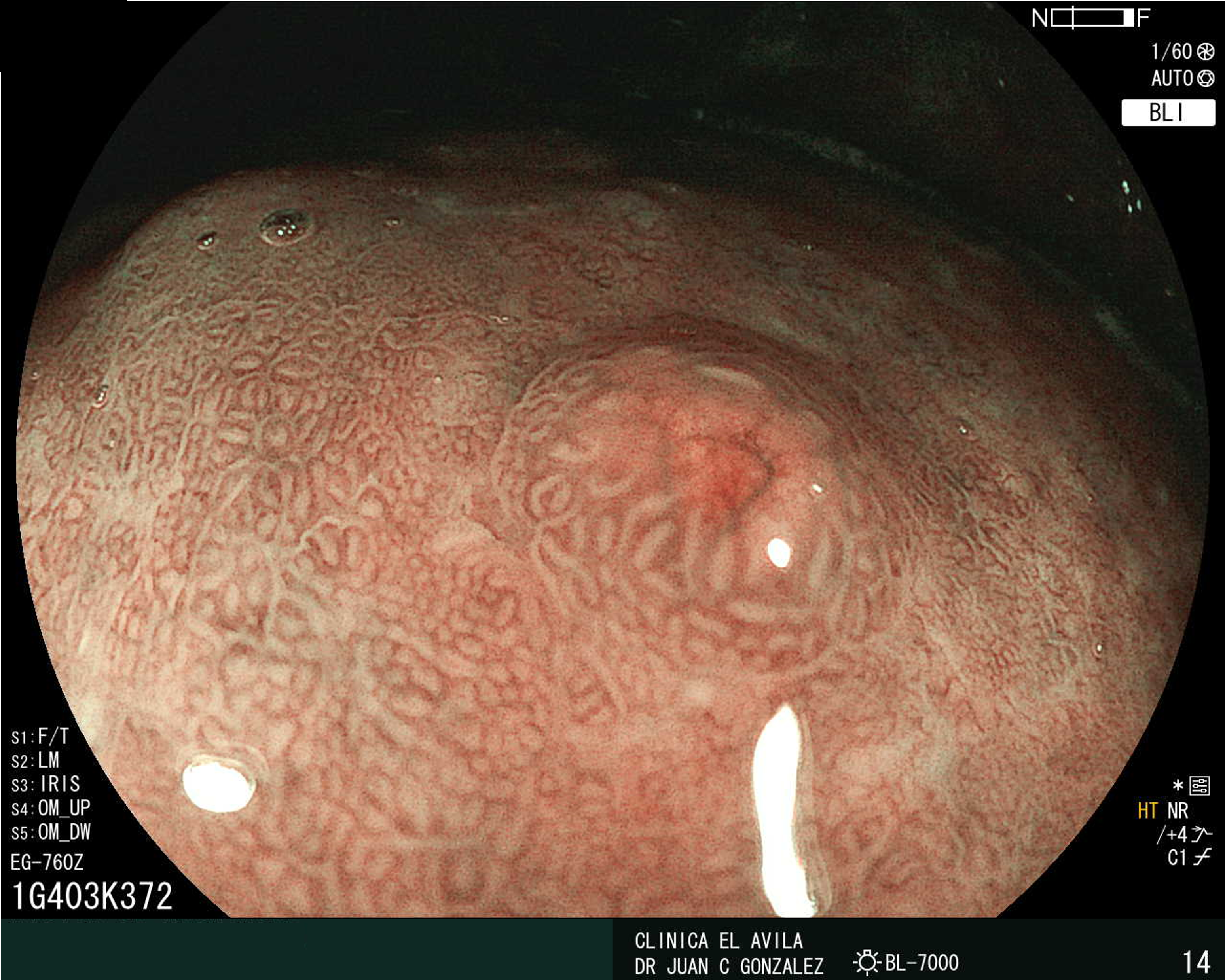
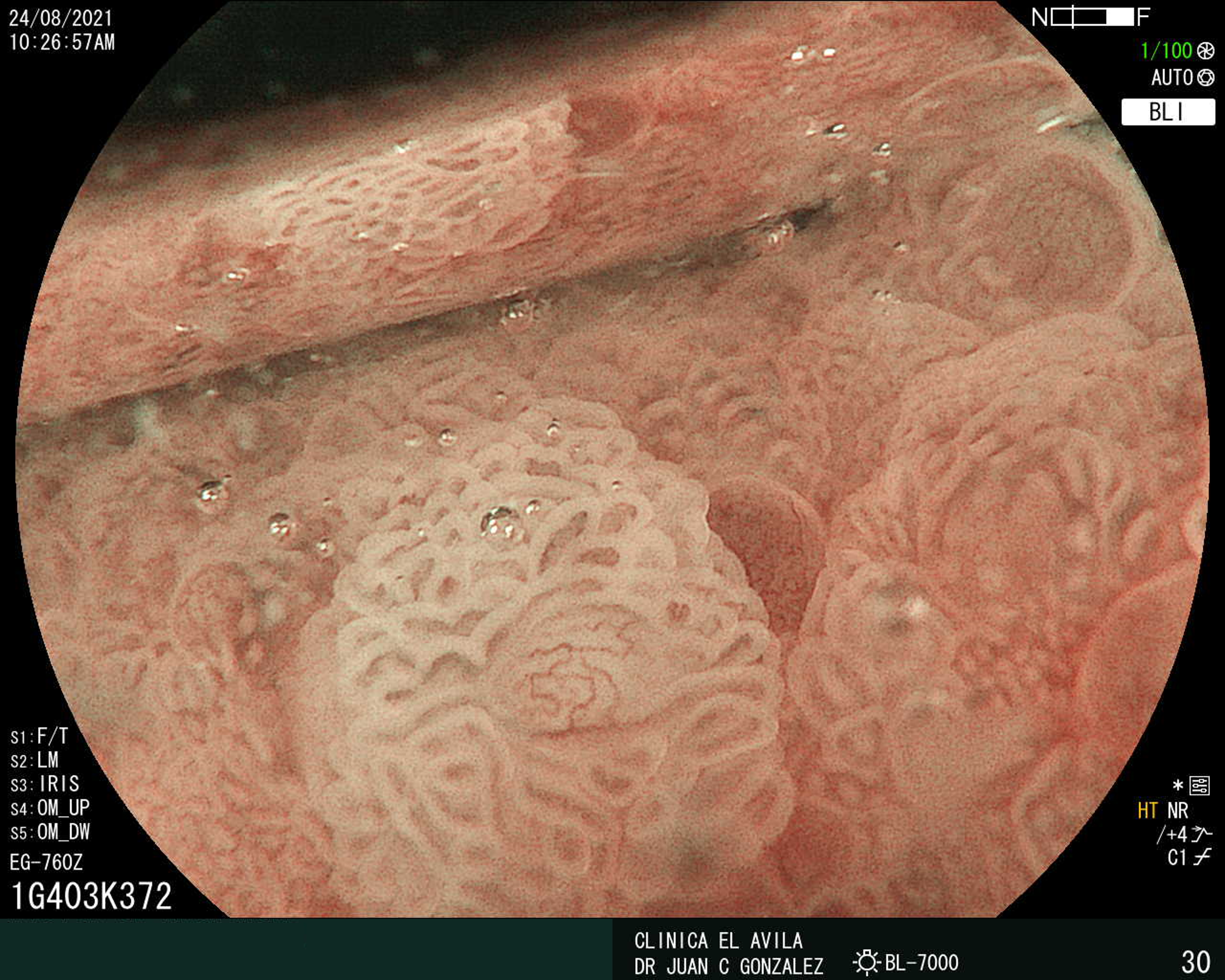
| Figura 1. Tumor Neuroendocrino Gástrico | Figura 2. Hiperplasia de Células Neuroendocrinas en estómago |
 |  |
 |  |  |
ISSN: 0016-3503 e-ISSN: 2477-975X